Campos vectoriales
Y teoría electrostática

Unidad 5.
Los fotones y la materia
5.1 Einstein y fotones
A principios del siglo XX, la física clásica de la mecánica analítica y la electrodinámica había tenido un gran éxito en proporcionar una comprensión del universo. Había pocas expectativas de que esto cambiara radicalmente como resultado de un descubrimiento bastante pequeño sobre la parcelación de energía en radiación térmica. Consideraremos los pensamientos de dos físicos teóricos sobre lo que ahora nos damos cuenta de que fue el comienzo de una revolución conceptual. Los físicos que hemos seleccionado son Planck y Einstein, en parte porque representan extremos en su respuesta a la teoría cuántica. Por un lado tenemos a Planck, que todavía no estaba seguro de cómo formular una comprensión de su creación. Y, por otro lado, tenemos a Einstein, que parecía no tener dificultad alguna con el cuanto, aunque sí vio algunas dificultades bastante serias con la electrodinámica de Maxwell y el tratamiento de átomos, moléculas y electrones. Tenga en cuenta también que, aunque no es relevante para el presente manuscrito, Planck y Einstein eran amigos personales.
Como una indicación de que Planck comprendía la importancia de su descubrimiento, muchos autores señalan los recuerdos del hijo de Planck, Erwin (Erwin Planck (1893-1945)). Erwin recordó que, en un paseo con su padre por la zona residencial de Grunewald, cerca de Berlín, su padre le dijo: "Hoy he hecho un descubrimiento tan importante como el de Newton". Aunque Erwin solo tenía siete años en ese momento. Sin embargo, parece que el sentido de Planck de lo objetivo de la ciencia lo fastidiaba. A pesar de la importancia del cuanto, el descubrimiento se basó en una conveniencia matemática que incluso Boltzmann pensó que no era física. La fórmula de Planck para la densidad de radiación era obviamente correcta, como lo demostraron los mejores datos disponibles. Entonces, la fórmula matemática fue fácilmente aceptada como verdadera. Sin embargo, apenas se notó el hecho matemático de que la fórmula de Planck se basaba en elementos discretos de energía ε. El propio Planck tuvo dificultades para deshacerse de la noción de que este elemento energético era simplemente una hipótesis matemática y no una propiedad real de la distribución de energía. Kragh señala que la incomodidad de Planck con el cuanto se evidencia en su silencio sobre el tema entre 1901 y 1906[1]. Al introducir el cuanto, Planck obtuvo la forma de la complexión que luego produjo la entropía en función de la energía del resonador, y todo el resto siguió de esto. La forma general de la entropía de la fórmula de Wien luego encaja como una clave para proporcionar la identidad ε=hν. Pero hubo algunos problemas graves. La relación crítica entre la densidad de energía de la radiación y la densidad de energía del resonador fue un resultado de la física clásica, ya que el resonador obedecía a la mecánica newtoniana y la radiación se describía en términos de las ecuaciones de Maxwell. Aunque Planck inicialmente tuvo dificultades para aceptar la idea de que la entropía podría disminuir en un instante en particular, en 1912 aceptó completamente que esto era válido, junto con la naturaleza estadística de la entropía. Sin embargo, el camino no fue sencillo y hubo problemas a lo largo del camino, que pueden haber permanecido. Planck parece haber diferido fundamentalmente de Boltzmann en su comprensión de la entropía estadística en 1906. Planck eligió (formalmente) ocuparse de la energía y la entropía de los resonadores individuales. La dificultad es que esto no fue simplemente una conveniencia matemática. En 1906, Planck escribió sobre el desorden de la distribución de energía y, por tanto, de la entropía de un solo resonador. Sin embargo, esto no es realmente consistente con la formulación de Boltzmann, aunque en la Conferencia de Solvay de 1911, admitió que estaba de acuerdo con la definición de complexión de Boltzmann. En 1910, Planck había aceptado que la discontinuidad cuántica era real y debía tenerse en cuenta en algún momento. Estaba convencido de que la electrodinámica de Maxwell describía completamente el campo de radiación. Pero el campo de radiación interactuó con los resonadores, que fueron cuantificados. Así que eligió el punto en el que haría el menor daño, que decidió que estaba en la excitación del resonador. Luego, en 1911, invirtió su posición y decidió que la introducción del cuanto en el proceso de emisión plantearía la menor cantidad de problemas. Parece haber sido influenciado por las ideas de Hendrik Lorentz (1853-1928) sobre las dificultades con la absorción de energía por un resonador en el régimen de alta frecuencia. Esta imagen en la que el proceso de emisión era discontinuo, pero el proceso de absorción y la energía intrínseca no lo eran, se ha denominado la segunda teoría de Planck[2]. Lo presentó en la Conferencia de Solvay en 1911. En 1912, en el prólogo de la segunda edición de su libro Vorlesungen über die Theorie der Wärmestrahlungen publicado en 1913, Planck escribió: "Un principio realmente nuevo simplemente no se puede expresar en un modelo funcional basado en leyes antiguas". El gran dilema de Planck parece haber sido éste: cómo escapar de los límites del modelo funcional, respetando los principios en los que se basa.
El 17 de marzo de 1905 Einstein envió un artículo “sobre la emisión y transformación de la luz desde un punto de vista heurístico” a Annalen der Physik[3]. Este es el manuscrito al que a menudo se hace referencia como el artículo del efecto fotoeléctrico, aunque el efecto fotoeléctrico es solo uno de los ejemplos considerados. Los objetivos de Einstein en el artículo iban mucho más allá de las dificultades involucradas en la comprensión del efecto fotoeléctrico. Einstein se había convertido en uno de los expertos mundiales en mecánica estadística durante los años 1902-1904 al desarrollar la teoría que había elaborado Gibbs en 1902[4]. En 1902 Einstein tenía solo un contacto limitado con la obra de Boltzmann y desconocía por completo el tratado de Gibbs. Sin embargo, este esfuerzo proporcionó a Einstein una comprensión profunda de la estructura de la materia y cómo las propiedades observables podrían obtenerse de la imagen atómica. También estaba completamente familiarizado con la electrodinámica de Maxwell, como lo demostraría su artículo sobre la teoría especial de la relatividad en junio de 1905. En la oración inicial del artículo escribió que: “Hay una diferencia profunda y formal entre las ideas teóricas que los físicos han formado sobre los gases y otros cuerpos ponderables, y la teoría de Maxwell de los procesos electromagnéticos en el llamado espacio vacío" (Einstein 1905). Y la energía presenta el mismo problema. La energía de la materia ponderable se encuentra en los átomos, moléculas y electrones, mientras que la energía del campo electromagnético es una función continua de las variables de espacio y tiempo. La imagen ondulatoria de la luz, por supuesto, había descrito con precisión los fenómenos ópticos. Sin embargo, Einstein señaló que todas las observaciones ópticas involucran promedios de tiempo. Luego sugirió que puede haber graves contradicciones si consideramos la emisión y absorción de radiación electromagnética. Le parecía que fenómenos como la emisión de radiación de cuerpo negro o la emisión de rayos catódicos (electrones) por radiación ultravioleta podría entenderse mucho mejor si la energía de la luz se tratara como discontinua. Teniendo en cuenta que la teoría electromagnética de la luz de Maxwell, apoyada por el éter luminífero, era la joya de la corona de la física del siglo XIX, Einstein iba en contra de la base misma de la teoría física en este punto. Escribió que trataría la energía electromagnética como discontinua, que consiste en un número finito de cuantos de energía localizados que se moverían sin división y quedarían totalmente absorbidos al interactuar con la materia. Luego anunció que describiría el proceso de pensamiento que lo llevó a esta conclusión con la esperanza de que algunos investigadores pudieran encontrarlo útil en sus investigaciones. La mayoría de sus lectores no lo siguieron por el camino.
Cuando recomendó a Einstein para ser miembro de la Academia Prusiana y como director del Kaiser Wilhelm Institut für Physik, Planck indicó que Einstein a veces fallaba en el blanco, como en este artículo que sesionamos, pero que esto no debería ser acusado de él. Esto debería proporcionar una mejor comprensión de los diversos puntos que planteó.
En cuanto a una de las dificultades con las que se enfrenta la teoría de la "radiación negra", Einstein definió en primer lugar el sistema que deseaba considerar. Eligió un “hohlraum” para el cual las paredes internas de la cavidad reflejaban totalmente. Dentro de la cavidad supuso que había moléculas de gas monoatómicas y electrones libres. Supuso que todas las colisiones serían elásticas. Además, supuso que había electrones ubicados en puntos muy separados en la pared de la cavidad y unidos entre sí por fuerzas longitudinales. Estos electrones de la pared interactuarían elásticamente con los electrones y átomos libres en la cavidad y emitirían y absorberían la radiación del cuerpo negro en la cavidad de acuerdo con la teoría del electromagnetismo de Maxwell. Llamó a estos resonadores de electrones de pared. El sistema de Einstein fue entonces el considerado por otros como Rayleigh y Planck. Los resonadores en la pared de la cavidad, las moléculas de gas y los electrones libres dentro de la cavidad y la radiación del cuerpo negro en la cavidad estaban todos en equilibrio termodinámico, y la temperatura termodinámica era uniforme en todas partes. Entonces, Einstein podría aplicar el conocido principio de equipartición a las partículas, incluidos los resonadores. De acuerdo con el principio de equipartición, cada término de energía cuadrática para cada partícula tendría una energía promedio de (1/2) (R / N) T, donde R es la constante universal de los gases y N es lo que Einstein llamó el "número real de moléculas" en un equivalente en gramos, y equilibrio termincoa temperatura T. Este era, por supuesto, el número de Avogadro, que solo se conocía aproximadamente en 1905. Einstein podría haber escrito k = R / N como la constante de Boltzmann, pero decidió no hacerlo. Cada resonador tenía términos de energía cinética y potencial cuadrática, dando a cada uno una energía promedio de tiempo de
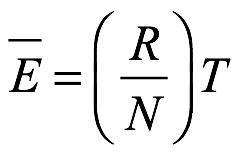 Ec. 1.1
Ec. 1.1
Según el teorema de equipartición, la energía cinética de traslación promedio de cada molécula (monoatómica) es (3/2) (R / N) T. Por lo tanto, la energía promediada en el tiempo de cada resonador es (2/3) la de cada molécula. En el caso de que a través de cualquier acción, en este caso a través de la radiación, la energía de un resonador particular sea mayor o menor que el promedio, la energía del resonador volverá al promedio a través de colisiones con las moléculas y los electrones libres. Entonces, un equilibrio dinámico es realmente posible solo cuando cada resonador tiene la energía promedio  . Por tanto, los resonadores están en equilibrio con la radiación del cuerpo negro, que estará presente en la cavidad, y la energía media de un resonador en el rango de frecuencia ν → ν + dν vendrá dada por
. Por tanto, los resonadores están en equilibrio con la radiación del cuerpo negro, que estará presente en la cavidad, y la energía media de un resonador en el rango de frecuencia ν → ν + dν vendrá dada por
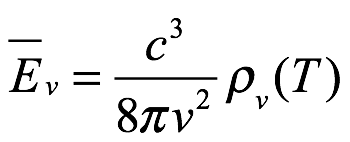 Ec. 1.2
Ec. 1.2
donde Einstein escribió L en lugar de c para la velocidad de la luz. Hemos vuelto ac para evitar confusiones y hemos utilizado la notación de Einstein 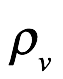 para la densidad de energía de radiación. La ecuación 1.2 es la relación de Planck para la densidad de energía del resonador en términos de la densidad de energía de radiación. Einstein citó el artículo de 1900 Annalen der Physik de Planck como fuente de (1.2[5]). Combinando Ec. (1.1) y (1.2) luego produce la densidad (por intervalo de frecuencia) de la radiación (campo) como
para la densidad de energía de radiación. La ecuación 1.2 es la relación de Planck para la densidad de energía del resonador en términos de la densidad de energía de radiación. Einstein citó el artículo de 1900 Annalen der Physik de Planck como fuente de (1.2[5]). Combinando Ec. (1.1) y (1.2) luego produce la densidad (por intervalo de frecuencia) de la radiación (campo) como
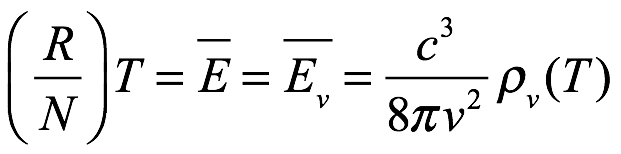
Por tanto, la densidad de energía de radiación es
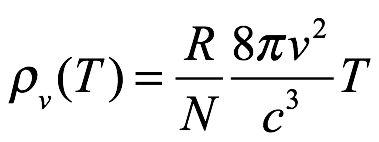 Ec. 1.3
Ec. 1.3
Einstein luego señaló que Ec. 1.3 no solo no está de acuerdo con el experimento, sino que también muestra que ya no podemos hablar de una distribución de energía entre la radiación y la materia (los resonadores). Específicamente, a medida que aumenta el rango de frecuencia de los resonadores, la energía en el campo de radiación resultante de los resonadores aumenta sin límite. Es decir,
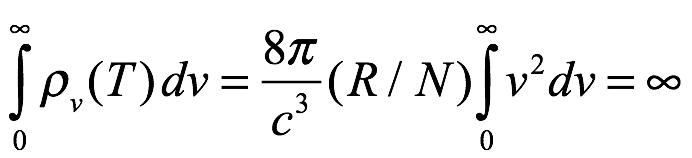 Ec. 1.4
Ec. 1.4
Esto es lo que Paul Ehrenfest (1880-1933) llamaría más tarde la “catástrofe ultravioleta”. Rayleigh había obtenido un resultado similar en su artículo de 1900 con ![]() , pero no había mencionado la dificultad[6]. Esto tampoco pareció preocupar a quienes trabajaban en esta área. Einstein fue el primero en señalar la verdadera dificultad que esto plantea. Este resultado no físico simplemente no se podía tolerar.
, pero no había mencionado la dificultad[6]. Esto tampoco pareció preocupar a quienes trabajaban en esta área. Einstein fue el primero en señalar la verdadera dificultad que esto plantea. Este resultado no físico simplemente no se podía tolerar.
5.2 Con respecto al resultado de Planck para los cuantos elementales
En lo que sigue, Einstein dijo que mostraría que los cuantos elementales y la teoría de la radiación del cuerpo negro propuesta por Planck eran hasta cierto punto independientes entre sí. Como señaló, todos los experimentos anteriores estaban de acuerdo con la fórmula de Planck
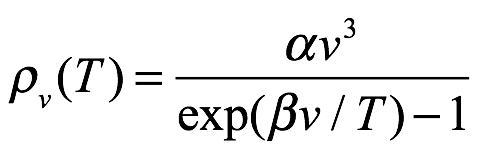 Ec. 1.5
Ec. 1.5
y proporcionó valores numéricos para α y β, que usaría más adelante en el artículo. Citó[7]. En el límite de longitud de onda larga (baja frecuencia), Einstein señaló que esto da
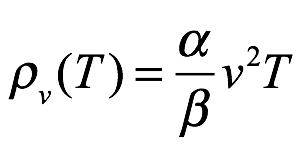 Ec. 1.6
Ec. 1.6
que concuerda con el experimento (es decir, los datos de Rubens y Kurlbaum). Pero luego fue más lejos. Combinó (1.3) y (1.6) para dar
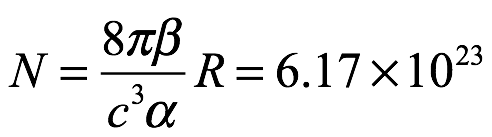 Ec. 1.7
Ec. 1.7
y notó que la masa de un átomo de hidrógeno era entonces 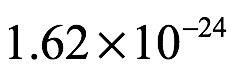 g. El resultado en (1.7) es, por supuesto, el número de Avogadro (para un equivalente en gramos), como señalamos anteriormente. Esto, escribió Einstein, concuerda con el valor que Planck había encontrado por otros medios y también con los valores que otros habían obtenido. Einstein concluyó que para densidades de alta energía y longitudes de onda largas, el análisis basado en una combinación de la teoría estándar de Maxwell con termodinámica estadística (ley de Wien y principio de equipartición) produce resultados que concuerdan con los experimentos. Sin embargo, señaló que "para longitudes de onda cortas y densidades bajas, estas fallan por completo". Entonces, ¿qué se debe hacer a continuación? Klein indica que la respuesta de Einstein fue proceder audazmente Einstein escribió: “En lo que sigue consideraremos la radiación del cuerpo negro en términos de resultados experimentales, ignorando cualquier imagen de la producción o dispersión de la radiación".
g. El resultado en (1.7) es, por supuesto, el número de Avogadro (para un equivalente en gramos), como señalamos anteriormente. Esto, escribió Einstein, concuerda con el valor que Planck había encontrado por otros medios y también con los valores que otros habían obtenido. Einstein concluyó que para densidades de alta energía y longitudes de onda largas, el análisis basado en una combinación de la teoría estándar de Maxwell con termodinámica estadística (ley de Wien y principio de equipartición) produce resultados que concuerdan con los experimentos. Sin embargo, señaló que "para longitudes de onda cortas y densidades bajas, estas fallan por completo". Entonces, ¿qué se debe hacer a continuación? Klein indica que la respuesta de Einstein fue proceder audazmente Einstein escribió: “En lo que sigue consideraremos la radiación del cuerpo negro en términos de resultados experimentales, ignorando cualquier imagen de la producción o dispersión de la radiación".
En cuanto a la entropía de la radiación, Einstein reconoció que algunas de las ideas que iba a presentar ya habían sido desarrolladas en una famosa obra de Wien. Aceptó que la densidad de energía de radiación ![]() . Einstein ahora incluía una dependencia de ν en lugar de simplemente poner ν como un subíndice, era conocida para todas las frecuencias (es decir, (1.5)), entonces la entropía del campo de radiación en la cavidad del volumen V tendría la forma
. Einstein ahora incluía una dependencia de ν en lugar de simplemente poner ν como un subíndice, era conocida para todas las frecuencias (es decir, (1.5)), entonces la entropía del campo de radiación en la cavidad del volumen V tendría la forma
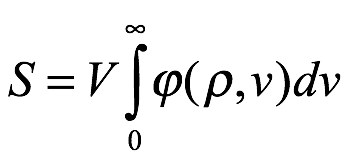 Ec. 1.8
Ec. 1.8
donde ? es la densidad de entropía del campo de radiación por intervalo de frecuencia dν. Para que la radiación sea un "cuerpo negro" y esté en equilibrio con las moléculas, los electrones y los resonadores, S debe ser un máximo, sujeto a la restricción de la energía de radiación constante. Es decir, utilizando el método de los multiplicadores indeterminados de Lagrange, con λ como multiplicador de Lagrange,
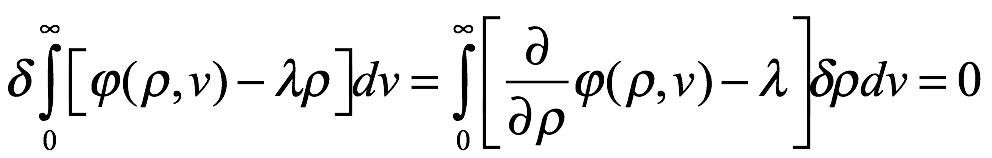
para variaciones arbitrarias  en la densidad de radiación
en la densidad de radiación  .
.
Esto requiere que
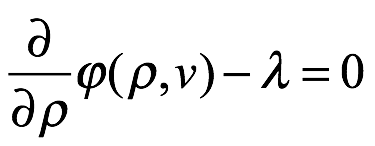
El multiplicador de Lagrange λ es independiente de ν. Por lo tanto, ∂? / ∂ρ también debe ser independiente de ν. Luego volvemos a (1.8), tomando el volumen como V = 1, y consideramos un cambio reversible en la temperatura del sistema dT. El cambio de temperatura dará como resultado un cambio en la densidad de energía ρ y un cambio correspondiente en la entropía del campo de radiación. De (1.8), este cambio en la entropía es
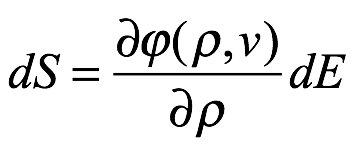 Ec. 1.9
Ec. 1.9
ya que la derivada parcial ∂? / ∂ρ es independiente de ν. Debido a que el cambio de energía dE es reversible, la termodinámica requiere que el cambio de energía del sistema a volumen constante V sea
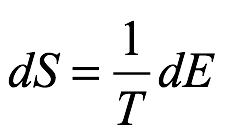 Ec. 1.10
Ec. 1.10
por la ecuación de Gibbs. Entonces, comparando (1.10) con (1.9), tenemos
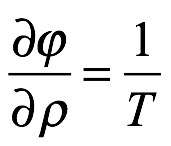 Ec. 1.11
Ec. 1.11
La ecuación (1.11) es lo que Einstein llamó la ley de radiación de cuerpo negro.
5.3 Forma límite de la entropía para radiación monocromática de baja densidad
El siguiente paso fue integrar (1.11) para obtener la densidad de entropía ?, observando que ? = 0 cuando ρ = 0. Para llevar a cabo la integración, Einstein necesitaba una ecuación para T en términos de ρ. Para ello, eligió utilizar la ley de Wien
que es, en términos de frecuencia,
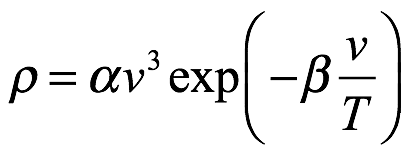 Ec. 1.12
Ec. 1.12
Señaló específicamente que la Ley de Wien no era aplicable en la región de longitud de onda larga que había considerado anteriormente, pero que para valores grandes de ν / T, estaba completamente de acuerdo con el experimento. También señaló que, como consecuencia, sus resultados serían aplicables solo en una determinada región. De la ley de Wien, tenemos
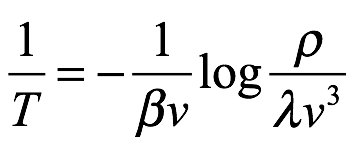
Entonces
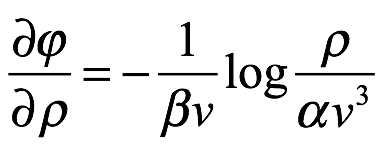 Ec. 1.13
Ec. 1.13
Y integrando
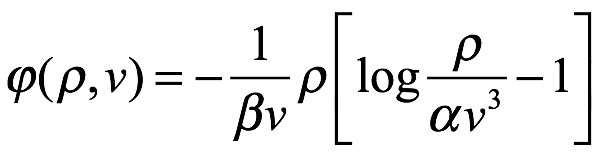 Ec. 1.14
Ec. 1.14
para la radiación que ocupa el volumen V con frecuencia en el intervalo ν → ν + dν. La energía de la radiación en este intervalo es E = Vpdν y la entropía de la radiación en este intervalo de frecuencia es S = V? (p, ν) dν. Por eso,
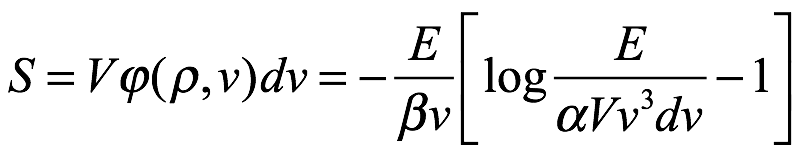 Ec. 1.15
Ec. 1.15
Si la misma radiación (misma temperatura e intervalo de frecuencia) ocupara un volumen V0, la entropía sería S0 con V reemplazado por V0 en (1.15). El cambio de entropía entre estas dos condiciones es
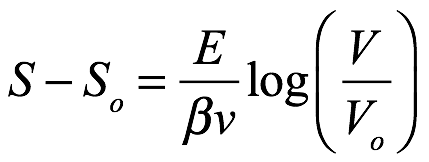 Ec. 1.16
Ec. 1.16
que, como señaló Einstein, es la misma forma que la diferencia de entropía para un gas ideal o una solución débil resultante de un cambio reversible de volumen (a temperatura constante). Esto también podría interpretarse, propuso, mediante la formulación de la entropía en términos de probabilidades, como había hecho Boltzmann.
Consideraciones teóricas moleculares sobre la dependencia de la entropía de los gases y las soluciones débiles del volumen
En el caso de las moléculas, señaló Einstein, la palabra "probabilidad" se utiliza a menudo en un contexto que no está cubierto por el concepto de probabilidad. En particular, la expresión "situaciones de igual probabilidad" se utiliza a menudo en situaciones para las que las condiciones son razonablemente bien conocidas, pero no con la precisión suficiente para una definición exacta. Einstein afirmó que demostraría en un trabajo posterior que el uso de la "probabilidad estadística" era suficiente en tales transformaciones térmicas. Esperaba poder finalmente dejar de lado cualquier problema lógico con respecto al uso del principio de Boltzmann aquí. Al menos, estaría considerando aquí un principio muy general y un caso bastante específico. Naturalmente, Einstein usó W (del alemán Wahrscheinlichkeit) para denotar la probabilidad, y nos quedaremos con esta notación. Si tiene sentido hablar de la probabilidad del estado de un sistema, y ??si cada aumento de entropía puede asociarse con una transición a un estado más probable, entonces la entropía de un estado está determinada por la probabilidad instantánea del estado en que el sistema se encuentra a sí mismo. Entonces dos sistemas que no interactúan tienen entropías S1 y S2 que son funciones de las probabilidades correspondientes
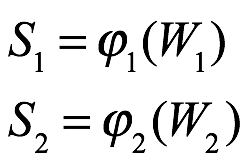
Y si consideramos estos dos sistemas como un solo sistema con una entropía S y una probabilidad de estado W, entonces
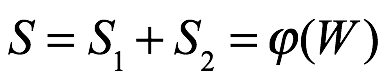
donde la probabilidad combinada W viene dada por
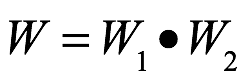
De estas ecuaciones se sigue que
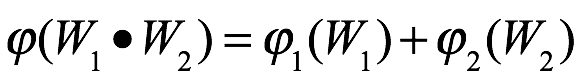
y finalmente eso
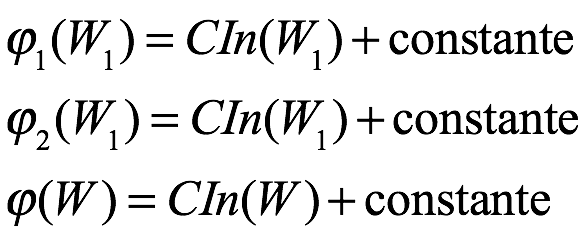
donde C es una constante universal. De la teoría cinética, sabemos que esta constante es R / N. Entonces, si S0 es la entropía de un estado de referencia y si W es la probabilidad relativa del estado con entropía S, tenemos
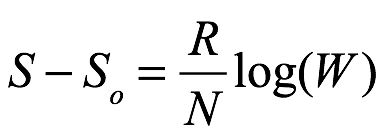 Ec. 1.17
Ec. 1.17
En este punto, Einstein eligió considerar un volumen V0 en el que hay un número n de puntos móviles (por ejemplo, moléculas) en los que eligió centrar la atención. En este mismo volumen V0, también hay otro conjunto de puntos móviles arbitrarios de otro tipo. No hizo ninguna suposición con respecto a las leyes del movimiento, excepto para insistir en que ninguna parte del volumen o la dirección sea excepcional. Eligió que el número de partículas del primer tipo fuera lo suficientemente pequeño como para que se despreciaran las fuerzas de interacción entre ellas. Cuando los n puntos móviles, considerados como gas ideal o solución ideal, ocupaban el volumen V0, Einstein denotaba la entropía de los n puntos por S0. Si entonces ocuparan un volumen V sin ningún otro cambio en el sistema, denotó su entropía con S. Ahora podría especificar la diferencia de entropía deducida del principio de Boltzmann. Einstein primero preguntó por la probabilidad de que los n puntos móviles estuvieran ubicados repentinamente en un volumen V, cuando en el instante anterior estaban en el volumen V0. Para esta probabilidad, dijo, podemos ofrecer solo la "probabilidad estadística”:
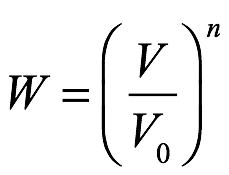 Ec. 1.18
Ec. 1.18
de donde el principio de Boltzmann da la diferencia de entropía como
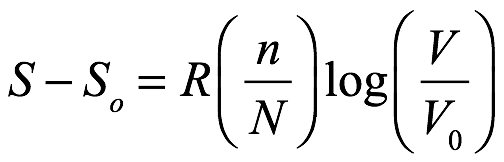 Ec. 1.19
Ec. 1.19
Según Einstein, era notable que la ley de Boyle-Gay-Lussac y la ley de la presión osmótica pudieran mostrarse termodinámicamente como resultado de la ecuación (1.19), sin imponer ningún requisito adicional al movimiento de las moléculas. Y realizó el cálculo que dio como resultado la ley de los gases ideales en una nota al pie.
Interpretación de la expresión de la dependencia de la entropía de la radiación monocromática con el volumen
Según el principio de Boltzmann, Einstein ya había obtenido una ecuación para el cambio de entropía de la radiación (monocromática) en la cavidad resultante de un cambio de volumen, a saber, (1.16). Y desde
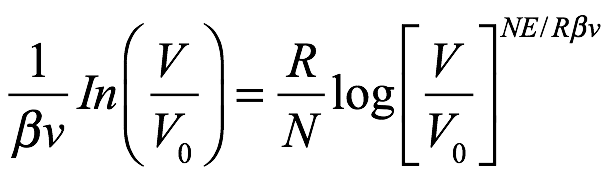
entonces podría escribir (1.16) como
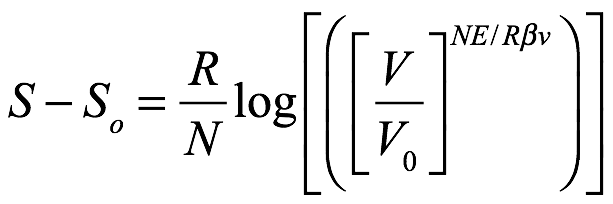 Ec. 1.20
Ec. 1.20
Si luego comparamos (1.20) con el principio de Boltzmann en la forma (1.17), llegamos a la conclusión de que la probabilidad de que la radiación monocromática de frecuencia ν contenida en un volumen V0 con paredes reflectantes en un instante particular de tiempo se contenga espontáneamente dentro de un volumen V es:
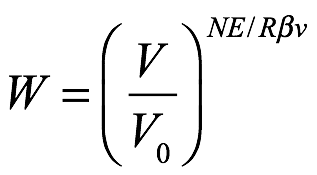 Ec. 1.21
Ec. 1.21
Los cuantos de energía tienen una magnitud ε = Rβν / N. El exponencial de la relación de volumen (V / V0) es entonces E / (Rβν / N) = E / ε = n, que es el número de cuantos de energía presentes. Por tanto, (1.21) es idéntico a (1.18). Usando este resultado, Einstein concluyó que la radiación monocromática de baja densidad (dentro de los límites de la fórmula de radiación de Wien) se comporta termodinámicamente como si constara de cuantos de energía independientes de magnitud Rβν / N en el intervalo de frecuencia ν → ν + dν. Si comparamos (1.12) con la fórmula de Planck en la región de alta frecuencia, vemos que
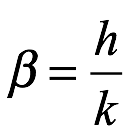
Entonces, con R / N = k, la energía del cuanto es ε = Rβν / N = hν, como había descubierto Planck. Aunque Einstein denotó el cuanto de energía por Rβν / N a lo largo de su artículo, usaremos el moderno ε = hν en la mayor parte de nuestra discusión más allá de este punto.
También notamos que Einstein no hizo ninguna propuesta con respecto a las leyes de movimiento de los cuantos de radiación. Pudo ignorar las leyes del movimiento porque la densidad de la radiación del cuerpo negro en la región de alta frecuencia (longitud de onda corta) es baja. Esto fue apropiado para su uso de la formulación de la entropía de Boltzmann, que se basa en probabilidades estadísticas. Luego, Einstein buscó la energía promedio de los cuantos de “radiación negra” para compararla con la energía de traslación promedio de las moléculas, que era (3/2) (R / N) T. Usando la fórmula de Wien (1.12) para la densidad de energía de radiación ρ, la energía promedio por cuanto es
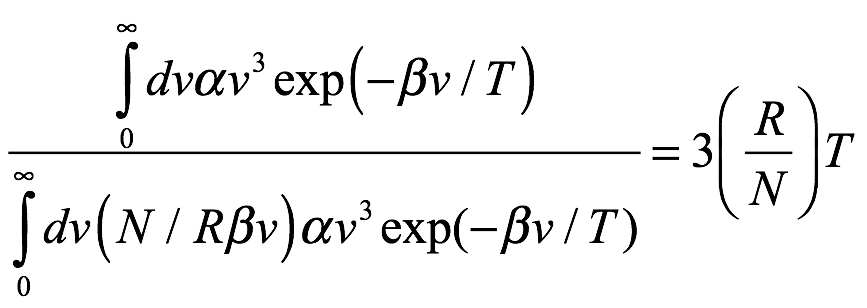 Ec. 1.22
Ec. 1.22
Ahora que había demostrado que la radiación, en una densidad suficientemente baja para ser descrita por la fórmula de Wien, podía considerarse compuesta de partículas en el sentido de la dependencia de la entropía de la radiación con respecto al volumen, Einstein sugirió que deberíamos preguntarnos si las leyes actuales de emisión y transmisión de luz estaban de acuerdo con las expectativas en el caso en que la luz consistía en partículas.
5.4 Con respecto a la Ley de Stokes
Einstein consideró la fotoluminiscencia en la que la luz monocromática de frecuencia ν1 (cuantos de energía hν1) se dirige sobre la materia y la luz con frecuencia ν2 se emite desde la materia. Otras frecuencias más bajas ν3,. . . , se pueden emitir νs y la materia también se puede calentar. El límite de energía que se encuentra al considerar que la luz está formada por cuantos es
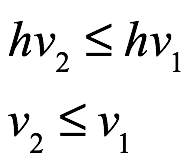
Esta es la ley de Stokes. También señaló que cada cuanto de luz entrante es capaz de producir el tipo de proceso elemental que da como resultado la emisión de otros cuantos de luz. Por lo tanto, no existe un límite inferior para la intensidad de la luz dirigida a la superficie por debajo de la cual no se produce luz.
En cuanto a la producción de rayos catódicos mediante la iluminación de superficies sólidas, Einstein se dedicó entonces a la obra de Lenard, que trata de la producción de rayos catódicos mediante la iluminación de materiales sólidos[8]. Este es el efecto fotoeléctrico. Einstein llamó a esto un trabajo “pionero” (Bahnbrechenden). Primero, Einstein señaló que es particularmente difícil comprender los resultados de los experimentos de Lenard si se parte de la idea de que la energía de la luz es continua. Luego consideró la imagen obtenida si se supone que la luz que incide en la superficie está cuantificada, como él proponía. Hay muchas posibilidades de que suceda dentro del cuerpo. Pero el más simple fue que el cuanto de luz se entrega por completo a un solo electrón (rayo catódico). Aunque en 1905 Thomson ya había desarrollado una imagen detallada del átomo, Einstein descartó cualquier complicación debida a la posible ionización de moléculas. Simplemente consideró que el electrón cedería algo de energía antes de llegar a la superficie del cuerpo material. Para dejar la superficie, el electrón también tuvo que superar la barrera potencial conocida como función de trabajo, que él denotó por P. La conservación de energía produjo la energía cinética del electrón que abandona el cuerpo material como
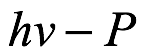 Ec. 1.23
Ec. 1.23
Ésta es la energía cinética máxima porque el cuanto de energía puede distribuirse entre varios electrones. Si se aplica un potencial positivo 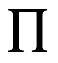 (notación de Einstein) al cuerpo, entonces ningún electrón dejará el cuerpo si
(notación de Einstein) al cuerpo, entonces ningún electrón dejará el cuerpo si
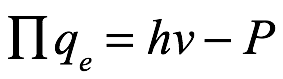 Ec. 1.24
Ec. 1.24
donde qe es la carga del electrón, o
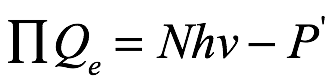
donde Qe es la carga en un gramo equivalente de un ion con carga simple y P '= NP. Einstein luego eligió ν para ser el ultravioleta ligado a la luz solar (1.03 × 1015 s − 1), fijó P = 0, presumiblemente porque no se conocía un valor razonable, usó el valor conocido para β de la ley de Wien y obtuvo 4.3 V para detener potencial, que estaba básicamente de acuerdo con los resultados de Lenard. Einstein escribió: "Hasta donde puedo ver, los resultados de nuestra propuesta no están en desacuerdo con los resultados experimentales de Lenard".
También señaló: “Si la fórmula que hemos derivado es correcta, debe ser una función lineal de la frecuencia ν de la luz excitante. Representada en coordenadas cartesianas, versus ν sería entonces una línea recta, cuya pendiente es independiente de la material que se está utilizando en el experimento ". Este experimento aún no se había realizado en 1905.
Con respecto a la ionización de un gas por luz ultravioleta, Einstein finalizó el artículo con un comentario sobre la ionización de moléculas de gas y comparó las predicciones de su teoría con los datos de Johannes Stark (1874-1957).
Átomos cuánticos
Veremos el modelo atómico de Bohr y la extensión del de Sommerfeld. Seguiremos el camino de Bohr desde Copenhague a Cambridge y luego a Manchester. Cuando el grupo de Rutherford en Manchester identificó el núcleo, los intentos de modelar el átomo enfrentaron un problema completamente nuevo. Había que disponer un número finito de electrones de forma dinámica alrededor del diminuto núcleo positivo. Pero la electrodinámica maxwelliana requería que los electrones en órbitas alrededor del núcleo irradiaran energía en forma de ondas electromagnéticas. Cuando su año postdoctoral en Inglaterra estaba llegando a su fin, Bohr presentó una propuesta a Rutherford para un modelo atómico. Veremos cómo esto lo llevó a su modelo, después de encontrar la serie numérica de Johann Balmer (1825-1898) para el espectro del hidrógeno. Seguiremos los pensamientos de Bohr tal como los expresó en el artículo de 1913, donde presentó su modelo[9]. Luego pasaremos a Sommerfeld, quien se puso en contacto con Bohr después de leer su artículo de 1913. Examinaremos el papel de Sommerfeld con cierto detalle, porque de hecho fue un maestro visionario. Al igual que otro gran maestro antes que él, Jacobi, trajo los resultados de su investigación a sus clases tan pronto como pudo, y trabajó para construir una fuerte conexión entre la teoría y el experimento. Sommerfeld le mencionó a Bohr que esperaba emprender un estudio del efecto Zeeman, algo que Bohr ya se había dado cuenta de que sería difícil. Pero Sommerfeld encontró su propio camino y fue capaz de elaborar una formulación que proporcionó un camino a seguir. Sin embargo, esto aún no era una teoría cuántica real y Sommerfeld finalmente dejó de modelar el átomo y pasó a algo que él llamó "misterios numéricos".
Niels Bohr: doctorado y Cambridge
Bohr nació y se educó en Copenhague, Dinamarca. Su padre era profesor de fisiología en la Universidad de Copenhague y su madre era de una destacada familia judía de Copenhague. La centralidad de Bohr en la nueva física se puede atribuir en parte a su personalidad, pero también al hecho de que provenía de un país pequeño que reconocía la importancia de la ciencia, pero que no era visto como una potencia científica. Ciertamente, las inclinaciones intelectuales de Bohr fueron alimentadas por la atmósfera intelectual en casa[10]. Bohr recibió su Ph.D. de la Universidad de Copenhague en mayo de 1911 con una disertación sobre electrones en metales, utilizando el modelo desarrollado por el físico teórico alemán Paul Drude (1863-1906). En el modelo de Drude, las estructuras sólidas resultan de un ordenamiento de sus iones constituyentes, es decir, los átomos menos sus electrones de valencia. Supuso que los electrones de valencia se movían libremente como un gas dentro del sólido. De acuerdo con el modelo de gas, las colisiones de los electrones con los iones y entre ellos se consideraron casi instantáneas, a pesar del largo alcance de la fuerza de Coulomb. Este modelo fue muy exitoso y todavía constituye la base para Imag5 simples y para obtener estimaciones aproximadas de las propiedades de los conductores.
En 1911, los físicos ya se estaban dando cuenta de las limitaciones de la teoría de Drude, y Bohr descubrió que, si los electrones se trataban con los métodos de la mecánica estadística, la teoría de Drude no podría explicar las propiedades magnéticas de los metales. Este resultado en particular llevó a Bohr a sospechar que sería necesaria una descripción no mecánica para el tratamiento de electrones en metales. Y esto dejó una marca indeleble en el enfoque de Bohr de la física y su construcción del átomo, que es nuestro tema aquí. Después de su doctorado, Bohr tomó un puesto postdoctoral con Thomson en el Laboratorio Cavendish en Cambridge. Esta no fue una situación feliz para Bohr. Su inglés era pobre, lo que no ayudó a los intentos de comunicación con Thomson. En un momento fue a Manchester para tomar un curso corto sobre radioisótopos con Rutherford, a quien Bohr reconoció como la figura creciente de la física inglesa. En un momento dado, el trabajo de laboratorio se detuvo, y Bohr se dedicó a reflexionar sobre las nuevas demandas relacionadas con el núcleo y el número limitado de electrones en el átomo. En poco tiempo, dejó a un lado su trabajo experimental y dedicó todo su tiempo a la construcción de modelos.
5.5 El modelo de Bohr
En julio de 1912, Bohr presentó un memorando a Rutherford para una discusión. El memo contenía los puntos:
1. El átomo nuclear es inherentemente inestable mecánicamente (mecánica newtoniana y electrodinámica maxwelliana).
2. Bohr propuso la estabilidad por decreto. La energía cinética T del electrón en órbita estaría dada por una relación de la forma
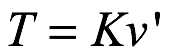 . Ec. 2.1
. Ec. 2.1
donde ν’ es la frecuencia de rotación orbital.
3. De lo contrario, el equilibrio de fuerzas habitual se mantendrá para las órbitas.
4. Se prohíbe la deformación de la órbita.
5. Bohr supuso que la constante K era del orden de la constante de Planck, h. Esperaba deducir esto de alguna manera.
6. El equilibrio de fuerzas de Bohr era simplemente
 Ec. 2.2
Ec. 2.2
donde a es el radio de la órbita y E es la carga del núcleo[11]. La energía cinética viene dada por (2.1).
Usaremos aquí unidades gaussianas, como Bohr. El invierno de 1912 encontró a Bohr de regreso en Copenhague con un trabajo de profesor en la universidad. En Copenhague leyó los artículos de John W. Nicholson (1881-1955), en los que proponía su propio modelo atómico. Nicholson había desarrollado un modelo nuclear independientemente de Rutherford, con electrones girando alrededor del núcleo. Había sugerido que el espectro de un átomo surge de las perturbaciones en el movimiento orbital del electrón perpendicular al plano de la órbita, que había demostrado que eran estables, aunque su análisis consideró solo átomos con hasta cinco electrones. En el modelo de Nicholson, las frecuencias perturbadas eran múltiplos de la frecuencia orbital ν, que podía elegirse arbitrariamente. Para una elección particular de ν, los resultados de las frecuencias emitidas coincidieron con el espectro del átomo de hidrógeno observado en ciertas nebulosas. Y las formas ionizadas de los átomos de Nicholson dieron otras líneas en la corona solar. Bohr notó que los momentos angulares en el átomo de Nicholson aparecían en múltiplos de (h / 2π). Esta cuantificación del momento angular del electrón le pareció importante. A Bohr le molestaba el hecho de que el átomo de Nicholson proporcionaba el espectro de emisión aparentemente correcto para el hidrógeno, mientras que su propio modelo no proporcionaba ninguna emisión. También albergaba una preocupación que era común a todos los que intentaban modelar la estructura atómica. Los espectros de los átomos simplemente se consideraban demasiado complicados para ser utilizados como base para cualquier modelo. Hemos visto esto en el hecho de que Thomson hizo ningún intento de calcular espectros a partir de su elaborado modelo atómico, aunque tenía suficientes electrones para proporcionar algún tipo de esquema. Según Heilbron, Bohr se enfrentó por primera vez al espectro de emisión del hidrógeno en una conversación con un colega en marzo de 1913. Este colega le había preguntado a Bohr cómo iba su trabajo sobre el átomo y, en particular, si su modelo tenía algo que decir sobre el espectro del hidrógeno. Bohr admitió que su modelo guardaba silencio sobre el espectro, aunque puede haber hecho algunos comentarios sobre la complejidad de los espectros en general. Su colega sugirió entonces que debería mirar el análisis del espectro de hidrógeno de Balmer. Balmer era un matemático suizo con un doctorado de la Universidad de Basilea. Permaneció en Basilea, donde enseñó en una escuela secundaria para niñas y dio conferencias en la universidad. En 1885 publicó una fórmula empírica para las longitudes de onda de las líneas en el espectro del hidrógeno:
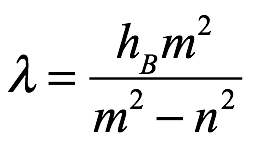
donde hB es una constante empírica, m es un número entero igual a 3, 4, 5. . ., y n = 2. Si escribimos esto en términos de la frecuencia ν = c / λ, entonces
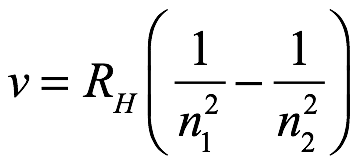
donde n1 = n y n2 = m y RH es la constante de Rydberg para el hidrógeno. Janne (Johannes) Rydberg (1854-1919) fue un matemático y físico sueco que tuvo una carrera bastante decepcionante en la Universidad de Lund, donde recibió su doctorado en 1879. La decepción no guarda relación con la capacidad de Rydberg, y obtuvo una alta calificación en la continente. La física sueca consideraba que la recopilación de los propios datos y el análisis posterior eran de suma importancia, mientras que el trabajo matemático de Rydberg sobre espectros se basaba en datos recopilados por otros. Cabe señalar que el trabajo de Rydberg precedió al de Balmer. Bohr dijo más tarde: "Tan pronto como vi la fórmula de Balmer, todo quedó inmediatamente claro para mí". Bohr envió un borrador de su primer artículo sobre teoría atómica a Rutherford el 6 de marzo de 1913, y Bohr y Rutherford se sentaron juntos para discutirlo en julio de 1913. En este primero de tres artículos sobre su modelo, Bohr comenzó describiendo el átomo nuclear de Rutherford y lo contrastó con J.J. Modelo de Thomson, en el que la carga positiva ocupaba todo el volumen atómico. Admitió que esto hacía imposible aceptar un proceso de equilibrio del tipo que había utilizado Thomson. También mencionó la teoría de los cuantos de Planck e indicó que desarrollaría una teoría basada en el cuanto.
De acuerdo con su memorando de 1912 a Rutherford, Bohr consideró un electrón de carga e girando alrededor de un núcleo de carga E. Admitió que, según la electrodinámica clásica, el electrón emitiría radiación y formaría una espiral hacia el núcleo. Generalmente, una órbita sería elíptica. Sin embargo, sugirió que podría haber ciertas órbitas circulares que serían estables en el sentido de que un electrón en una de estas órbitas no emitiría radiación. En una órbita tan estable de radio a, se mantendría la mecánica clásica. La energía potencial del electrón en órbita es
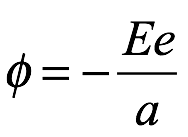 Ec. 2.3
Ec. 2.3
La energía cinética T del electrón en la órbita estable puede obtenerse de un equilibrio de fuerza radial para el electrón, es decir,
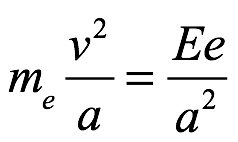 Ec. 2.4
Ec. 2.4
Entonces T es
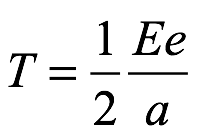 Ec. 2.5
Ec. 2.5
De (2.3) y (2.5), la energía orbital total es
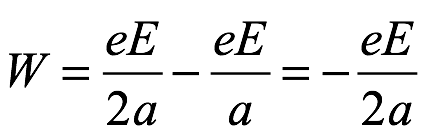 Ec. 2.6
Ec. 2.6
donde hemos introducido el término W de Bohr para esta energía orbital total. También notamos que la energía orbital total es igual en magnitud a la energía cinética. El signo negativo indica una órbita limitada. Nuestra ecuación (2.6) es una de las dos ecuaciones etiquetadas como (1) en el artículo de Bohr de 1913. Bohr usó ω para denotar la frecuencia de rotación del electrón en una órbita estable. Esto es lo que denotó con ν en su memorando de 1912 a Rutherford. La velocidad del electrón en órbita es entonces
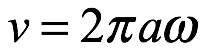
y la energía orbital total, que es igual en magnitud a la energía cinética del electrón en órbita, es
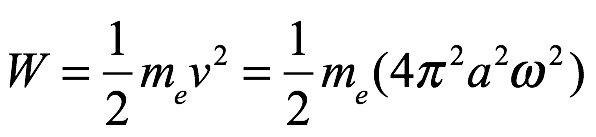 Ec. 2.7
Ec. 2.7
De (2.7), tenemos
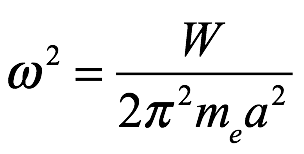 Ec. 2.8
Ec. 2.8
Con (2.6) y (2.8) se convierte en
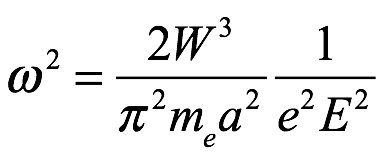 Ec. 2.9
Ec. 2.9
o
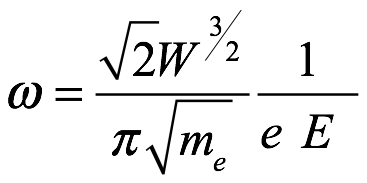 Ec. 2.10
Ec. 2.10
La ecuación (2.10) fue la segunda de las dos ecuaciones que Bohr etiquetó como (1). Observamos que W determina tanto el radio orbital a y la frecuencia orbital ω. En este punto, Bohr señaló que Planck cuantificó la radiación de los osciladores de electrones como τ hν, donde τ era un número entero. Bohr supuso que la radiación homogénea se emitiría a una frecuencia ν, que era la mitad de la frecuencia orbital ω, y que la cantidad de radiación emitida sería τ hν. Entonces W, que es la magnitud de la energía total, viene dada por
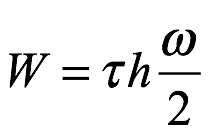 Ec. 2.11
Ec. 2.11
La ecuación (2.11) se etiquetó como (2) en el artículo de Bohr. Usando (2.11) para el valor de ω en (2.10), obtenemos
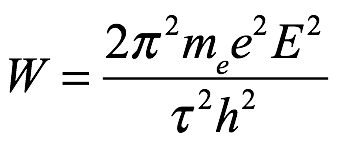 Ec. 2.12
Ec. 2.12
Entonces, eliminando W entre (2.11) y (2.12), obtenemos
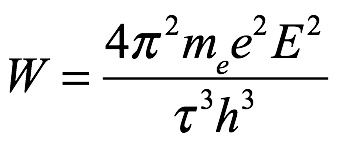 Ec. 2.13
Ec. 2.13
Y con (2.12) y (2.6) se convierte en
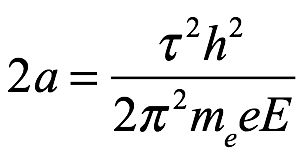 Ec. 2.14
Ec. 2.14
Las últimas tres ecuaciones (2.12), (2.13) y (2.14) se etiquetaron como (3) en el artículo de Bohr. Con los (entonces) valores conocidos para e, e/m y h, Bohr calculó que el diámetro orbital del electrón 2a era 1.1 × 10−8 cm, la frecuencia orbital ω era 6.2 × 1015 s−1, y la energía de enlace (ionización) por carga W / e será de 13 V.
Luego, en la secc. 2 del artículo, Bohr consideró el átomo de hidrógeno eligiendo E=e. El estado τ tiene entonces la energía orbital
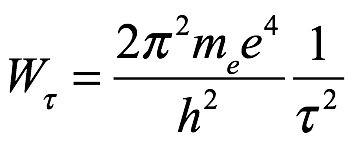 Ec. 2.15
Ec. 2.15
Para dos de estos estados τ1 y τ2 con energías Wτ1 y Wτ2, el cambio de energía en el
La transición entre estos estados es
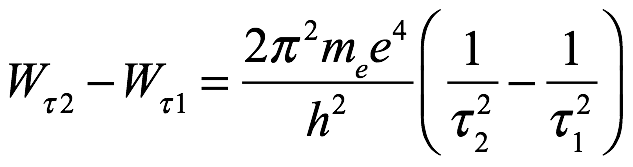 Ec. 2.16
Ec. 2.16
En esta transición, se emite radiación homogénea a una frecuencia ν según
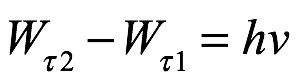 Ec. 2.17
Ec. 2.17
Es decir,
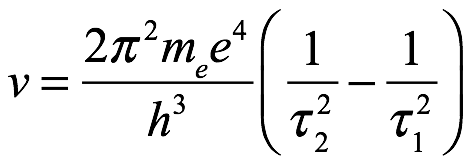 Ec. 2.18
Ec. 2.18
De esta manera, el modelo de Bohr predijo un valor de la constante de Rydberg para el hidrógeno como ![]() . En 1913, el valor aceptado de esta constante era
. En 1913, el valor aceptado de esta constante era ![]() . Ese es el modelo de Bohr que había ajustado el espectro de hidrógeno dentro del 5,8%. Notó esto en la Secta. 2 de su artículo. En la Secta. 3 Bohr discutió su uso de la ecuación. (2.11) de la forma en que imaginó que el átomo de hidrógeno estaba construido a partir de un núcleo libre y un electrón libre. Se puede producir el átomo de Bohr sin considerar la formación del átomo, y esto se hace normalmente en los libros de texto elementales si se proporciona la derivación. Sin embargo, Bohr consideró una liberación general de energía al formar el átomo
. Ese es el modelo de Bohr que había ajustado el espectro de hidrógeno dentro del 5,8%. Notó esto en la Secta. 2 de su artículo. En la Secta. 3 Bohr discutió su uso de la ecuación. (2.11) de la forma en que imaginó que el átomo de hidrógeno estaba construido a partir de un núcleo libre y un electrón libre. Se puede producir el átomo de Bohr sin considerar la formación del átomo, y esto se hace normalmente en los libros de texto elementales si se proporciona la derivación. Sin embargo, Bohr consideró una liberación general de energía al formar el átomo 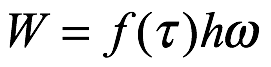 y concluyó que la forma final del espectro aún estaría dada por (2.18).
y concluyó que la forma final del espectro aún estaría dada por (2.18).
5.5.1 Arnold Sommerfeld
Königsberg era la ciudad natal de Sommerfeld, por lo que inscribirse en la Universidad Albertus en Königsberg después de su Gymnasium Abitur (graduación de la escuela secundaria preparatoria) puede haber sido bastante lógico. Sin embargo, permanecer únicamente en una universidad era inusual en Alemania. También pasó a formar parte de una fraternidad (Burschenschaft Germania), lo que obligó a participar en borracheras y duelos de esgrima. Uno de ellos dejó una cicatriz visible en la frente de Sommerfeld. En el verano de 1891, concibió y escribió su disertación y recibió su doctorado en matemáticas en Königsberg con Ferdinand Lindemann (1852-1939[12]). David Hilbert (1862-1943) fue Privatdozent en Königsberg mientras Sommerfeld era estudiante. Gracias a la influencia de Felix Klein (1849-1925), Hilbert recibió un puesto de profesor de matemáticas en Gotinga en 1895. Bajo el liderazgo de Klein y Hilbert, Gotinga se convirtió en un centro mundial de matemáticas. A través de algunas conexiones personales, Sommerfeld logró obtener un puesto durante un año en el Instituto Mineralógico de Gotinga, después de lo cual pasó dos años como asistente de Klein. Parte de su tarea consistía en copiar las notas de la conferencia de Klein en forma legible para la sala de lectura. Allí escribió su Habilitationsschift sobre difracción y se quedó en Gotinga como Privatdozent en matemáticas.
Después de Gotinga, Sommerfeld aceptó una cita en la Bergakadamie (escuela de minería) en Clausthal en 1897, lo que le proporcionó el apoyo financiero para casarse. Luego, en 1900, como resultado de los esfuerzos de Klein, se convirtió en profesor de ingeniería en el RWTH de Aquisgrán. En 1906, después de 6 años en Aquisgrán, Sommerfeld obtuvo un puesto como profesor de física teórica y director del nuevo Instituto de Física Teórica de la Universidad Ludwig Maximilian de Munich (LMU).
Pensamientos e ideas
En los años previos a su llegada a Munich, el interés y la capacidad de Sommerfeld en la enseñanza eran evidentes. Al igual que un exprofesor de matemáticas, Jacobi, lo había hecho una vez en Königsberg, Sommerfeld llevó los resultados de su investigación a sus conferencias. También construyó sus conferencias en torno a los problemas que enfrenta la física y la ingeniería para atraer a los estudiantes comprensión de cómo afrontar problemas reales. E involucró a los estudiantes en discusiones después de la cena en su casa o como parte de extenuantes excursiones en los Alpes bávaros[13].
En 1922, Einstein le escribió a Sommerfeld: "Lo que más admiro de ti es la forma en que, a un paso de tu pie, un gran número de talentosos jóvenes teóricos surgen de la tierra[14]". La cantidad de físicos verdaderamente grandiosos que surgieron de LMU mientras Sommerfeld estaba allí indica que su visión realmente trajo resultados. Lo que Sommerfeld había formado en la LMU era esencialmente una escuela, en el sentido de un grupo definido localmente bajo la influencia de un maestro carismático. Sin embargo, no existía una forma común de pensar en Munich, lo que podría tomarse como una característica más de una escuela. Sommerfeld se propuso en particular desarrollar el pensamiento independiente. Hoy, sin embargo, existe el Centro Arnold Sommerfeld de Física Teórica en LMU. Sommerfeld insistió en tener instalaciones experimentales en el Instituto de Física Teórica, una idea que pudo haber ganado en Aquisgrán. Estas fueron las instalaciones que utilizó clandestinamente el asistente de Sommerfeld, Walter Friedrich, para descubrir la difracción de rayos X en 1912. Sin embargo, sus intentos de mezclar ambos aspectos de la física no fueron tan exitosos como esperaba y finalmente llegaron a su fin. En la Naturforscherversammlung de 1907, Sommerfeld defendió públicamente la relatividad especial de Einstein. Esto lo colocó entre los primeros conversos junto con Planck. Luego, en la Naturforscherversammlung de 1909, Sommerfeld conoció a Einstein y formaron un vínculo inmediato, a pesar de sus diferencias. Sin embargo, el tema de interés para ellos en esta primera reunión no fue la relatividad, sino la teoría cuántica. Sommerfeld no estaba preparado para seguir a Einstein aquí. Fue más conservador con respecto a la teoría de Maxwell y optó por proceder con más cautela, como lo había hecho Planck.
Al año siguiente, el trabajo de Sommerfeld y las interacciones con los estudiantes provocaron un cambio en su posición intelectual. Se convenció de la importancia de lo cuántico y fue a Zurich para pasar una semana con Einstein, discutiendo la luz y la teoría cuántica con algunas excursiones a la relatividad. Sommerfeld estaba avanzando hacia la introducción de un ansatz formal en el enfoque clásico (Maxwell / Lorentz) de la interacción de la radiación con los átomos. Evidentemente, la acción tuvo una importancia central. Así que parecía razonable hacer que Ansatz, en cualquier proceso físico como la emisión de radiación, incluida la bremsstrahlung, o el efecto fotoeléctrico, la integral de acción total debería ser
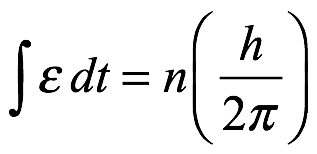 Ec. 2.19
Ec. 2.19
donde 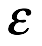 es energía y t es tiempo. Es decir, es la acción la que se cuantifica, en lugar de la energía. Esta idea fue central en el documento que presentó en la Conferencia de Solvay de 1911.
es energía y t es tiempo. Es decir, es la acción la que se cuantifica, en lugar de la energía. Esta idea fue central en el documento que presentó en la Conferencia de Solvay de 1911.
El tema de la Conferencia de Solvay de 1911 fue "Teoría de la radiación y cuántos". El nombre de Sommerfeld no apareció en las primeras comunicaciones sobre la conferencia, por razones que hemos visto aquí. Pero la avalancha de papeles que envió después de sus discusiones con Einstein pronto cambió eso. Y el artículo de Sommerfeld en la conferencia despertó un interés considerable. Sin embargo, la idea de cuantificación de la acción finalmente no condujo a ninguna parte y Sommerfeld la abandonó en 1913. No obstante, la idea había sido importante para Nicholson y Bohr. Esta fue la fuente de la cuantificación del momento angular orbital en los modelos del átomo de hidrógeno.
5.6 Efecto Zeeman
En el verano de 1913, después de la publicación de Bohr de su modelo del átomo de hidrógeno, Sommerfeld envió una comunicación personal muy amistosa a Bohr. Sommerfeld se estaba volviendo escéptico de los modelos atómicos y lo admitió plenamente. Sin embargo, le había impresionado la precisión del cálculo de Bohr de la constante de Rydberg. Sommerfeld cerró su carta mencionando que le gustaría investigar el efecto Zeeman (la división de una línea espectral en componentes mediante la aplicación de un campo magnético) sobre la base del modelo de Bohr. A través de su propia experiencia, Bohr sabía que esto no iba a ser sencillo. Pieter Zeeman (1865-1943) informó de las primeras observaciones del efecto de un campo magnético aplicado sobre la radiación emitida por un elemento en 1896. Estos fueron publicados en inglés en Philosophical Magazine en 1897. En 1902 Zeeman compartió el Premio Nobel de Física con Lorentz por su descubrimiento del efecto Zeeman. Las principales medidas de Zeeman fueron el ensanchamiento de las líneas de sodio D bajo la influencia de un fuerte campo magnético. Discutió sus resultados con Lorentz, quien respondió con un análisis del movimiento de un electrón que órbita en un campo de fuerza central en el plano horizontal cuando actúa sobre un campo magnético de intensidad H en la dirección vertical. Las ecuaciones newtonianas que describen el movimiento de los electrones en esta situación son
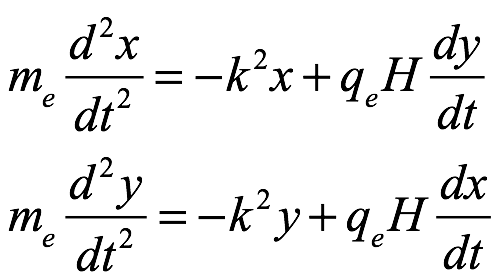 Ec. 2.20
Ec. 2.20
donde 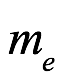 y
y 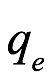 son la masa y carga del electrón. Las soluciones son periódicas. Si H=0, el período es
son la masa y carga del electrón. Las soluciones son periódicas. Si H=0, el período es ![]() . Si
. Si ![]() , el período se convierte en
, el período se convierte en ![]() (
(![]() ). Es decir, la teoría de los electrones de Lorentz predijo una separación de la línea (en dos líneas). Zeeman solo informó de una clara ampliación. No pudo discernir una separación. La situación física que describió Lorentz es lo que se conoció como el efecto Zeeman normal. Hay otro patrón espectroscópico que se conoció como efecto Zeeman anómalo, que en realidad es más común que el efecto Zeeman normal. Wolfgang Pauli (1900-1958) comentó que el efecto Zeeman anómalo era muy hermoso y, al mismo tiempo, difícilmente comprensible. Recordó una ocasión en la que paseaba sin rumbo fijo por las hermosas calles de Copenhague cuando un colega se encontró con él y le preguntó por qué se veía tan infeliz. Pauli dijo que su respuesta fue bastante feroz: "¿Cómo puede uno verse feliz cuando uno está pensando en el efecto Zeeman anómalo?" Sommerfeld se dio cuenta de que para emprender un estudio del efecto Zeeman basado en un modelo de Bohr, primero necesitaba generalizar la descripción cuántica para aplicarla a sistemas con más de un grado de libertad, lo que sería difícil. Sin embargo, comenzó a obtener resultados prometedores y en el semestre de invierno de 1914–15 ya estaba incluyendo sus resultados iniciales en sus conferencias. Había expandido su integral de acción (2.19) definiendo las variables de acción
). Es decir, la teoría de los electrones de Lorentz predijo una separación de la línea (en dos líneas). Zeeman solo informó de una clara ampliación. No pudo discernir una separación. La situación física que describió Lorentz es lo que se conoció como el efecto Zeeman normal. Hay otro patrón espectroscópico que se conoció como efecto Zeeman anómalo, que en realidad es más común que el efecto Zeeman normal. Wolfgang Pauli (1900-1958) comentó que el efecto Zeeman anómalo era muy hermoso y, al mismo tiempo, difícilmente comprensible. Recordó una ocasión en la que paseaba sin rumbo fijo por las hermosas calles de Copenhague cuando un colega se encontró con él y le preguntó por qué se veía tan infeliz. Pauli dijo que su respuesta fue bastante feroz: "¿Cómo puede uno verse feliz cuando uno está pensando en el efecto Zeeman anómalo?" Sommerfeld se dio cuenta de que para emprender un estudio del efecto Zeeman basado en un modelo de Bohr, primero necesitaba generalizar la descripción cuántica para aplicarla a sistemas con más de un grado de libertad, lo que sería difícil. Sin embargo, comenzó a obtener resultados prometedores y en el semestre de invierno de 1914–15 ya estaba incluyendo sus resultados iniciales en sus conferencias. Había expandido su integral de acción (2.19) definiendo las variables de acción ![]() y
y ![]() de la mecánica analítica, que son, para la órbita con variables (r, v)
de la mecánica analítica, que son, para la órbita con variables (r, v)
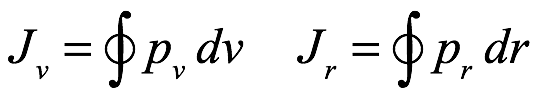 Ec. 2.21
Ec. 2.21
ya que ![]() . A partir de estas definiciones, pudo obtener la fórmula de Balmer para la energía del n-ésimo nivel de hidrógeno como
. A partir de estas definiciones, pudo obtener la fórmula de Balmer para la energía del n-ésimo nivel de hidrógeno como
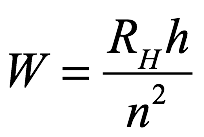 Ec. 2.22
Ec. 2.22
donde 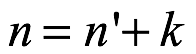 . Observamos que (2.22) es (2.15) con τ = n. Para cada uno de los números cuánticos de Bohr n, Sommerfeld tenía un grupo de órbitas elípticas identificadas por k = 1, 2, 3,. . . , n. La órbita con k = n era circular y la que tenía k = 1 tenía la mayor excentricidad. El número cuántico n identifica una órbita de Bohr y ahora se denomina número cuántico principal. El ángulo ϑ es el ángulo azimutal y el número cuántico k es el número cuántico azimutal. Finalmente, el número cuántico de proyección m tomó valores m = −k, −k + 1,. . . , + k, con m = 0 excluido. El valor de m especifica la orientación de la órbita en el espacio. Para cada valor positivo de m, hubo un valor negativo de m. En ausencia de un campo magnético, por ejemplo, todas las orientaciones eran idénticas.
. Observamos que (2.22) es (2.15) con τ = n. Para cada uno de los números cuánticos de Bohr n, Sommerfeld tenía un grupo de órbitas elípticas identificadas por k = 1, 2, 3,. . . , n. La órbita con k = n era circular y la que tenía k = 1 tenía la mayor excentricidad. El número cuántico n identifica una órbita de Bohr y ahora se denomina número cuántico principal. El ángulo ϑ es el ángulo azimutal y el número cuántico k es el número cuántico azimutal. Finalmente, el número cuántico de proyección m tomó valores m = −k, −k + 1,. . . , + k, con m = 0 excluido. El valor de m especifica la orientación de la órbita en el espacio. Para cada valor positivo de m, hubo un valor negativo de m. En ausencia de un campo magnético, por ejemplo, todas las orientaciones eran idénticas.
André Ampère (1775-1836) había sugerido que el magnetismo en la materia provenía de bucles de corriente microscópicos. En el modelo de Bohr-Sommerfeld, los electrones en órbita aparentemente se ajustan al modelo de Ampère. Hubo un momento magnético asociado con cada órbita elíptica de magnitud μBm, donde mB = qe (h / 2π) / (2me) es el magneton de Bohr, que fue identificado por el conjunto de números cuánticos (n, k, m). El momento magnético asociado con esa órbita es entonces μ (n, k, m). En presencia de un campo magnético externo de intensidad H, esta órbita tiene una energía adicional μ (n, k, m) · H. Los valores ± m implican entonces una diferencia en la energía de los estados resultante de la aplicación de un campo magnético, como Zeeman había observado.
Órbita de Bohr-Sommerfeld con m = ± 1 en presencia de un campo magnético externo de intensidad H. El nivel anterior único se divide por ± μBH
 12.17.08.png)
La figura es una imagen simplificada de la situación para los números cuánticos n = 1, k = 1, m = ± 1, en presencia de un campo magnético externo H. Las energías de los niveles identificados por los números cuánticos de proyección ± m son desplazado por las cantidades 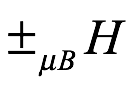 . Este cambio de energías debería ser observable espectroscópicamente, como había hecho Zeeman. Sin embargo, existía una dificultad asociada con la polarización de la onda impuesta en las mediciones de absorción. Si uno trata la órbita de manera clásica, como lo hizo Lorentz, y como tenía que hacerlo en 1915, el efecto de una onda electromagnética en las órbitas de la figura será diferente dependiendo de si la onda está polarizada a lo largo o en paralelo a H. Específicamente el el índice de refracción de la materia en estudio dependerá de la polarización de la onda de medición. Este fenómeno se conoce como birrefringencia. En este caso, el fenómeno sería una birrefringencia inducida magnéticamente. En la primavera de 1916 Sommerfeld tenía lo que parecía ser una teoría cuántica definitiva para el efecto Zeeman, y su alumno Paul S. Epstein (1883-1966) tuvo un éxito similar con el efecto Stark (la división de una línea espectral en componentes mediante la aplicación de un campo eléctrico). El trabajo de Sommerfeld y Epstein tuvo un efecto muy positivo en la aceptación del modelo de Bohr. Y Sommerfeld escribió esto en su Atombau und Spektrallinien (1919), a la que a menudo se hacía referencia como la "Biblia" de la física atómica. En este punto Sommerfeld inició una relación de trabajo muy fructífera con el gran experimentalista Paschen. Juntos descubrieron un problema crítico. El esquema de órbitas múltiples de Sommerfeld proporcionaba más órbitas de las que Paschen había encontrado experimentalmente en la fina estructura de
. Este cambio de energías debería ser observable espectroscópicamente, como había hecho Zeeman. Sin embargo, existía una dificultad asociada con la polarización de la onda impuesta en las mediciones de absorción. Si uno trata la órbita de manera clásica, como lo hizo Lorentz, y como tenía que hacerlo en 1915, el efecto de una onda electromagnética en las órbitas de la figura será diferente dependiendo de si la onda está polarizada a lo largo o en paralelo a H. Específicamente el el índice de refracción de la materia en estudio dependerá de la polarización de la onda de medición. Este fenómeno se conoce como birrefringencia. En este caso, el fenómeno sería una birrefringencia inducida magnéticamente. En la primavera de 1916 Sommerfeld tenía lo que parecía ser una teoría cuántica definitiva para el efecto Zeeman, y su alumno Paul S. Epstein (1883-1966) tuvo un éxito similar con el efecto Stark (la división de una línea espectral en componentes mediante la aplicación de un campo eléctrico). El trabajo de Sommerfeld y Epstein tuvo un efecto muy positivo en la aceptación del modelo de Bohr. Y Sommerfeld escribió esto en su Atombau und Spektrallinien (1919), a la que a menudo se hacía referencia como la "Biblia" de la física atómica. En este punto Sommerfeld inició una relación de trabajo muy fructífera con el gran experimentalista Paschen. Juntos descubrieron un problema crítico. El esquema de órbitas múltiples de Sommerfeld proporcionaba más órbitas de las que Paschen había encontrado experimentalmente en la fina estructura de  . Sommerfeld pudo enmendar esto y alinear su teoría con los resultados de Paschen al definir un conjunto de reglas de selección, que eran simples, pero bastante arbitrarias.
. Sommerfeld pudo enmendar esto y alinear su teoría con los resultados de Paschen al definir un conjunto de reglas de selección, que eran simples, pero bastante arbitrarias.
Aunque la energía dependía solo del número cuántico principal para el caso no relativista, Sommerfeld mostró que la variación en la velocidad de los electrones en una órbita elíptica podría contribuir a un cambio relativista en la masa. Encontró que la contribución relativista resultante daba un buen acuerdo cuantitativo con la estructura fina espectral observada, que se consideró un triunfo tanto para las teorías cuántica como para las de la relatividad.
En 1913, Peter Debye (1884-1966) publicó lo que podemos considerar una expresión más racionalizada para la cuantificación de la condición de momento angular orbital que la que había proporcionado Bohr. La condición de Debye se basaba en la variable de acción y era esencialmente la misma que la primera condición de Sommerfeld en (2.21), es decir, 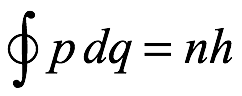 en la que q y p son la coordenada generalizada y el momento de la mecánica analítica. Esto estaba fechado el 10 de febrero de 1913 (Utrecht) y parece haber precedido al acceso de Debye a la publicación de Bohr. Luego, Debye se dedicó a la difracción de rayos X, con la esperanza de obtener resultados que proporcionaran pruebas de las órbitas de Bohr, trabajando con su joven asistente suizo Paul Scherrer (1890-1969). El hecho de que Debye fuera holandés y Scherrer suizo significó que su trabajo no se vio afectado por el comienzo de la guerra en 1914. Sin embargo, no encontraron evidencia de rayos X para corroborar las ideas de Bohr.
en la que q y p son la coordenada generalizada y el momento de la mecánica analítica. Esto estaba fechado el 10 de febrero de 1913 (Utrecht) y parece haber precedido al acceso de Debye a la publicación de Bohr. Luego, Debye se dedicó a la difracción de rayos X, con la esperanza de obtener resultados que proporcionaran pruebas de las órbitas de Bohr, trabajando con su joven asistente suizo Paul Scherrer (1890-1969). El hecho de que Debye fuera holandés y Scherrer suizo significó que su trabajo no se vio afectado por el comienzo de la guerra en 1914. Sin embargo, no encontraron evidencia de rayos X para corroborar las ideas de Bohr.
Mientras estaban en Gotinga, después de 1913, Debye produjo un tratamiento de las órbitas de Bohr, basado en el Hamiltoniano, que era más sistemático que el de Sommerfeld. Bohr utilizó esto en su artículo para las Actas de la Academia de Copenhague en 1918. En relación con esto, Debye también produjo un estudio del efecto Zeeman basado en las orientaciones de las órbitas. Este fue publicado casi simultáneamente con la publicación de Sommerfeld que consideramos anteriormente. En 1918 Bohr escribió: "Posteriormente, el propio Sommerfeld y Debye han indicado en la misma línea una interpretación del efecto de un campo magnético en el espectro de hidrógeno que [...] sin duda representa un paso importante hacia una comprensión detallada de este fenómeno".
En el átomo de hidrógeno, solo hay un electrón, por lo que una u otra de las dos órbitas que hemos dibujado en la figura estará ocupada:
Por lo tanto, un solo átomo de hidrógeno en un campo magnético externo tendrá un momento magnético alineado o anti-alineado con el campo magnético externo. Este también será el caso de un átomo con un solo electrón de valencia, que puede considerarse que tiene los niveles de hidrógeno asociados con un núcleo blindado con carga igual a la unidad. En cada uno de estos casos, esperaríamos que un gas de estos átomos estuviera compuesto por una distribución estadística de átomos con momentos magnéticos alineados o anti-alineados con el campo magnético externo. El número cuántico de proyección m determina la orientación espacial del momento magnético orbital del electrón. Por lo tanto, existe una cuantificación espacial que puede usarse para distinguir átomos.
Más allá de los modelos
Los años entre 1919 y 1926 vieron un cambio en el enfoque de Sommerfeld. Ya no creía que los átomos multielectrónicos pudieran abordarse de una manera teórica general basada en primeros principios. En cambio, se volvió hacia los datos. Donde anteriormente había hablado de armonías numéricas, ahora usó el término "misterios numéricos". Él y sus alumnos tuvieron éxito. Y el enfoque estaba siendo adoptado por otros científicos atómicos. Pero este no era el camino hacia una comprensión más profunda de la estructura atómica. Para eso, debemos mirar al grupo que trabaja con Born at Göttingen y a Erwin Schrödinger (1887–1961) trabajando solo y discutiendo matemáticas con Hermann Weyl (1885–1955).
El modelo atómico de Bohr fue un paso audaz hacia lo desconocido. No se construyó sobre fuertes principios físicos, pero resultó en la serie de Balmer para el espectro, una vez que Bohr vio la conexión. También podría extenderse a átomos con electrones de valencia simple y capas internas llenas. El modelo de Bohr fue un éxito y siguió siendo un tema central durante bastante tiempo. Bohr había introducido el concepto de estado atómico. Las transiciones entre estos estados dieron como resultado la emisión o absorción de radiación electromagnética. No había ninguna explicación de cómo podría ocurrir esta transición, y a algunos les pareció una deficiencia. La cuestión del estado atómico reveló algo así como una nueva forma de pensar sobre la física del átomo. Sommerfeld abordó el problema del efecto Zeeman utilizando sólidos principios de la mecánica analítica y, de hecho, tuvo cierto éxito. La estructura atómica que surgió puede denominarse modelo de Bohr-Sommerfeld. Notamos que Debye procedió de manera similar a Sommerfeld, manteniéndose cerca de la mecánica analítica. Este sería el camino general seguido en una ruta general hacia una mecánica cuántica real. Como señalamos, esto también impresionó a Bohr.
5.7 Onda de partículas de De Broglie
El príncipe Louis Victor Pierre Raymont de Broglie (1892–1987), a quien normalmente se hace referencia simplemente como Louis de Broglie, en realidad tenía un título heredado, que obtuvo después de la muerte de su hermano mayor Maurice (1875–1960), como el sexto duque de Broglie. Los de Broglie fueron una familia importante en Francia y durante generaciones sirvieron a Francia como soldados, políticos y diplomáticos. Cuatro de Broglies eran Mariscales de Francia. Sin embargo, la Revolución Francesa no fue una época fácil para la familia, y al menos uno murió en la guillotina. A la muerte de su padre en 1906, Maurice asumió la responsabilidad de la educación de su hermano menor Louis. Aunque Maurice obtuvo el título de Docteur des Sciences en 1908, inicialmente no animó a Louis a estudiar ciencias. Más bien pensó que Louis era el más adecuado para la política y la diplomacia. Sin embargo, en 1911, Maurice se desempeñó como uno de los secretarios de la primera Conferencia Solvay. Junto con Paul Langevin (1872–1946), fue responsable de preparar las notas de las discusiones que se publicarían en las actas de la conferencia. Louis pudo leer las notas y se entusiasmó con los problemas de las teorías cuánticas y de la relatividad que se estaban discutiendo. Luego cambió al estudio de las ciencias. En 1913 recibió su Licencia de Ciencias en la Universidad de la Sorbona en París y eligió cumplir con su obligación militar. Al año siguiente, comenzó la Primera Guerra Mundial y Louis y Maurice estuvieron totalmente ocupados con eso hasta 1919.
Maurice de Broglie fue un oficial naval retirado que, durante la guerra, inventó un receptor de radio para submarinos. Louis fue asignado a una estación de transmisión de radio en la Torre Eiffel, a poca distancia de donde se encontraba Léon Brillouin (1889-1969). Brillouin realizó algunos experimentos con Louis y participó con Maurice en el montaje y prueba del receptor submarino. Después de la guerra, Louis trabajó con Maurice en su laboratorio privado creado para estudiar rayos X. Como resultado, pudo publicar algunos artículos breves y se involucró en largas discusiones con Maurice sobre la verdadera naturaleza de los rayos X. Estas discusiones, dijo Louis, lo hicieron reflexionar profundamente sobre la necesidad continua de conectar los aspectos de onda y partícula de estos rayos. Su tiempo en el laboratorio de Maurice también le dio a Louis la oportunidad de publicar algunos de sus pensamientos formativos sobre los fotones de Einstein, a los que llamó partículas de luz. Agregó algunas ideas sobre los orígenes de la interferencia usando partículas de luz. Louis también tuvo conversaciones con Léon Brillouin sobre las ondas de materia. Una vez, con Brillouin, consideró la observación de Rutherford de que las partículas α y β se doblaban en direcciones opuestas en un campo magnético, mientras que los rayos γ no se veían afectados. Según Brillouin, de Broglie dijo que todos debían ser muy similares: tenían que ser todo ondas o todo partículas. Brillouin relata que De Broglie tuvo que pensar y preguntarse mucho antes de que finalmente se le ocurriera la idea de que una partícula de luz con energía hν tendría un momento hν/c. Finalmente apareció como una sola oración en un artículo que De Broglie escribió en enero de 1922. Brillouin creía que el origen de la idea de onda de fase de De Broglie residía en esta observación. El concepto final de las ondas de materia cristalizó para De Broglie en el verano de 1923. Dijo que las largas discusiones que había tenido con su hermano siempre llegaban a el mismo punto: los rayos X tenían que ser ondas y partículas al mismo tiempo. En algún momento de ese verano llegó a la convicción de que esta dualidad tenía que extenderse a las partículas materiales. Específicamente, los electrones tenían que tener esta naturaleza dual. Y recordó la ecuación de Hamilton-Jacobi de la mecánica clásica. Esta ecuación representa la formulación más elegante de la mecánica de partículas, pero también se puede utilizar para tratar la óptica geométrica y, en particular, el principio de Fermat para los rayos de luz, que se puede formular como una generalización del principio variacional de Hamilton. Durante ese verano, de Broglie escribió tres notas para la revista Comptes rendus, que luego aparecieron en su tesis.
La tesis de De Broglie
La idea central que de Broglie planteó en su tesis doctoral de 1923 fue que un cuerpo material en movimiento siempre podría considerarse como un fenómeno ondulatorio. No podía basar esto simplemente en las largas conversaciones con su hermano o incluso con Brillouin. El desarrollo de Einstein del fotón, que consideramos en la Secc. 3.3 fue fundamental en su pensamiento. Pero esto fue solo una adición a las ideas que ya pudo haber tenido sobre los rayos X. Ahora tenía una formulación teórica de su idea fundamental, con la que podía comenzar su tesis. Introdujo su tesis con un estudio de la historia de la física desde el siglo XVI hasta el siglo XX, incluido un análisis de las ideas de Einstein sobre la luz, pero comenzó el primer capítulo presentando la onda de fase, que fue fundamental para el desarrollo formal de la luz. su idea. A continuación presentaremos las ideas que de Broglie desarrolló en el primer capítulo de su tesis. Para esclarecerlos, nos desviaremos por momentos de su presentación. Sin embargo, nuestra designación de subsecciones sigue la suya.
La Onda de Fase. La Relación entre las Teorías Cuántica y de la Relatividad
Primero de Broglie recordó la equivalencia de materia y energía que se expresa como
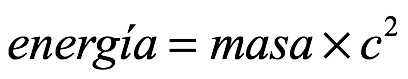 Ec. 3.1
Ec. 3.1
El principio de inercia nos dice que un cuerpo en reposo tiene una masa inercial de m0 y una energía propia de 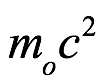 . Si ese cuerpo está en movimiento con una velocidad de
. Si ese cuerpo está en movimiento con una velocidad de 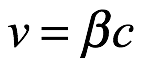 , entonces la masa del cuerpo es
, entonces la masa del cuerpo es 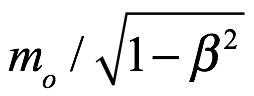 y la energía es
y la energía es 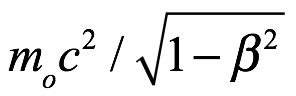 . Para introducir los cuantos en la dinámica relativista, a de Broglie le pareció que la idea principal de la teoría cuántica era la imposibilidad de considerar una cantidad de energía sin atribuirle una frecuencia ν según
. Para introducir los cuantos en la dinámica relativista, a de Broglie le pareció que la idea principal de la teoría cuántica era la imposibilidad de considerar una cantidad de energía sin atribuirle una frecuencia ν según
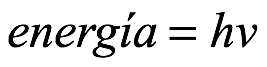 Ec. 3.2
Ec. 3.2
donde h es la constante de acción de Planck. A esto lo llamó la relación cuántica. Aunque consideraba que la acción era una noción muy abstracta, señaló que parecía desempeñar un papel importante en la teoría cuántica. Sin embargo, después de una considerable reflexión sobre los cuantos de luz y el efecto fotoeléctrico, decidió centrarse en la energía en lugar de la acción. Dio con la siguiente meta-ley: a cada masa propia podemos asociarle una frecuencia 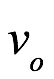 igualando
igualando 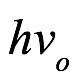 a la energía propia como
a la energía propia como
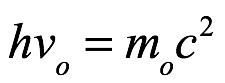 Ec. 3.3
Ec. 3.3
donde la frecuencia ν0 se mediría en el marco de reposo de lo que denominó paquete o paquete de energía. La ecuación (3.3), escribió, sería la base de la teoría que estaba desarrollando. Admitió que, como con cualquier hipótesis, solo sería tan buena como las consecuencias que pudieran deducirse de ella. También optó por referirse a la velocidad límite c como la “velocidad límite de la energía” (citas en el original), por razones que prometió explicar. De hecho, estaba desarrollando cuidadosamente una idea a la que había llegado durante esas largas discusiones con su hermano y con Brillouin. Preguntó si deberíamos considerar el movimiento periódico asociado con 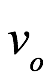 , como se define en (3.3), como un movimiento en el interior de la parcela de energía. El electrón podría considerarse el arquetipo de un paquete aislado de energía o materia, pero señaló que el electrón existiría en todo el espacio y no estaría aislado. De Broglie luego consideró la frecuencia del movimiento asociado con un movimiento. paquete de energía. Este paquete de energía podría ser estudiado por alguien que se mueve con el paquete o alguien estacionario que observa el paquete en movimiento. El tiempo asociado con el movimiento periódico parecería ser ralentizado por el movimiento del paquete. El observador estacionario mediría una frecuencia ν1 para el paquete en movimiento, que, usando (3.3), es
, como se define en (3.3), como un movimiento en el interior de la parcela de energía. El electrón podría considerarse el arquetipo de un paquete aislado de energía o materia, pero señaló que el electrón existiría en todo el espacio y no estaría aislado. De Broglie luego consideró la frecuencia del movimiento asociado con un movimiento. paquete de energía. Este paquete de energía podría ser estudiado por alguien que se mueve con el paquete o alguien estacionario que observa el paquete en movimiento. El tiempo asociado con el movimiento periódico parecería ser ralentizado por el movimiento del paquete. El observador estacionario mediría una frecuencia ν1 para el paquete en movimiento, que, usando (3.3), es
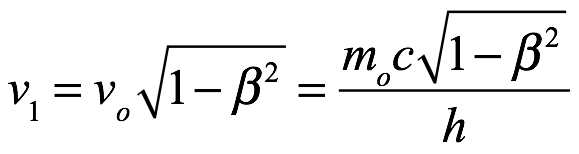 Ec. 3.4
Ec. 3.4
Dado que el paquete se está moviendo, el observador estacionario encontraría que la masa es 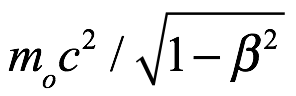 y le asociaría una frecuencia
y le asociaría una frecuencia
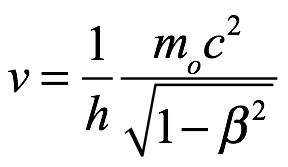 Ec. 3.5
Ec. 3.5
Las frecuencias ν1 y ν son diferentes. Este hecho, escribió de Broglie, lo había intrigado durante mucho tiempo y fue lo que lo llevó al teorema de la armonía de fase:
El fenómeno aperiódico visto por un observador estacionario tiene una frecuencia 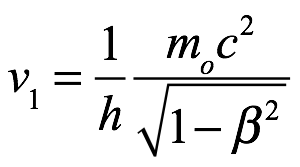 que parece estar constantemente en fase con una onda de frecuencia
que parece estar constantemente en fase con una onda de frecuencia 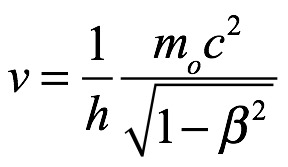 propagándose en la misma dirección con una velocidad V = c/β.
propagándose en la misma dirección con una velocidad V = c/β.
Para establecer esto, de Broglie supuso que había armonía de fase inicialmente, en el tiempo t = 0 para cada observador. También supuso que el fenómeno periódico, que identificó como un objeto en movimiento, se había movido una distancia x = βct en el tiempo t. El observador estacionario registraría entonces la fase de la onda con frecuencia ν1 en el tiempo t como
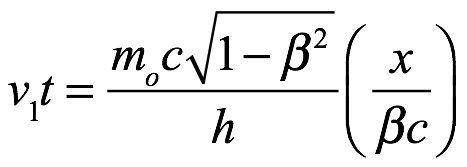 Ec. 3.6
Ec. 3.6
Tomando el tiempo registrado por un observador que se mueve con el objeto (el tiempo propio de la relatividad) como t0, luego de la transformación de Lorentz
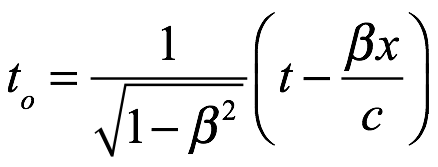 Ec. 3.7
Ec. 3.7
La fase para este observador que se mueve con el objeto es entonces ν0t0, que, con (3.3), es
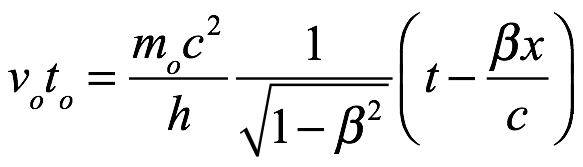 Ec. 3.8
Ec. 3.8
Como t = x/βc, (3.8) se convierte en
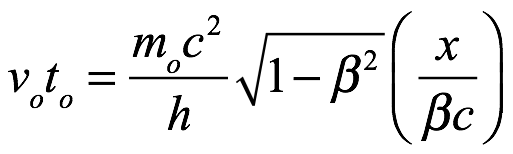 Ec. 3.9
Ec. 3.9
Vemos que (3.9) y (3.6) son idénticas. Esta igualdad establece la teoría de de Broglie
de armonía de fase.
Queda la observación al final del enunciado del teorema de armonía de fase de que la velocidad de la onda es V = c/β. Como β < 1, la onda que estamos considerando tiene una velocidad mayor que la velocidad de la luz. De Broglie nota esto y acepta que esta onda no puede transportar energía. Dado que el teorema también se ocupa de la fase de la onda, señala que, por lo tanto, se trata de una onda de fase.
Velocidades de fase y de grupo
El concepto de onda de fase es algo que encontramos en una representación de Fourier de un pulso electromagnético que se propaga. Un estallido muy breve de energía electromagnética que surge, por ejemplo, de una lámpara de destellos se representa mediante un grupo de ondas de fase con una dispersión de frecuencias y la correspondiente dispersión de velocidades. De Broglie ya había afirmado que se podía pensar en el electrón como un paquete de energía y había hablado de una onda asociada con este paquete, pero no identificó la onda como el paquete. En su tesis, de Broglie concluyó que la velocidad de la onda de fase era V = c/β, usando la geometría del espacio-tiempo de Hermann Minkowski (1864–1909). No seguiremos aquí el enfoque geométrico del espacio-tiempo. Más bien obtendremos la velocidad de onda de fase como parte de una descripción general de la representación de onda de fase de un paquete de energía, ya que esto sigue el enfoque de de Broglie sobre el tema. Consideramos que la parcela de energía (el electrón) está representada por un grupo de ondas de fase con frecuencias en el entorno de ν, es decir, ν → ν + δν, y velocidades en el entorno de V, es decir, V → V + δV . Específicamente, considerando dos de tales ondas, su suma es
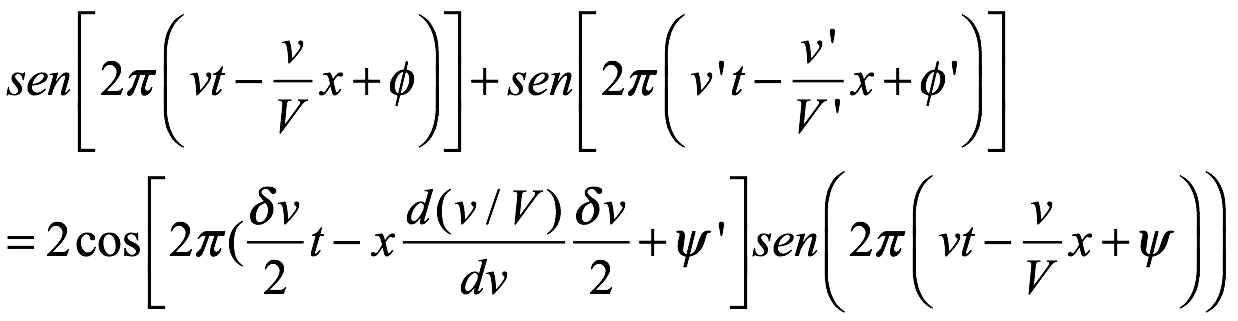 Ec. 3.10
Ec. 3.10
La suma de las dos ondas sinusoidales ligeramente separadas produce una sinusoide modulada por una onda coseno a la frecuencia δν/2. La velocidad de esta onda coseno se denota por U, donde:
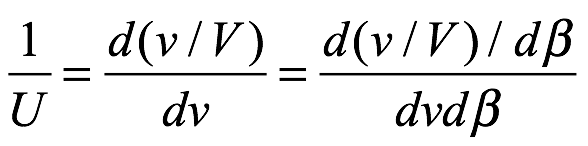 Ec. 3.11
Ec. 3.11
Esta U es la velocidad de grupo de la onda modulada. Es la velocidad a la que se transporta la energía y, por lo tanto, es la velocidad a la que se mueve el paquete de energía (el electrón).
Para calcular la velocidad del grupo, comenzamos con ν de (3.5) para obtener
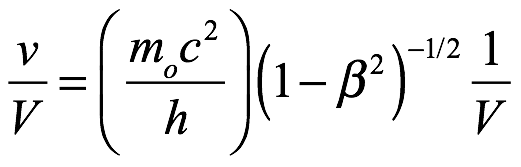 Ec. 3.12
Ec. 3.12
Entonces:
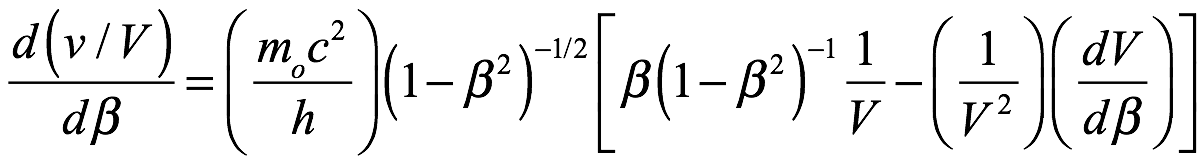 Ec. 3.13
Ec. 3.13
Y de (3.5), tenemos
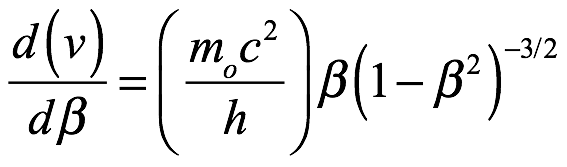 Ec. 3.14
Ec. 3.14
Por lo tanto, de (3.13) y (3.14), tenemos
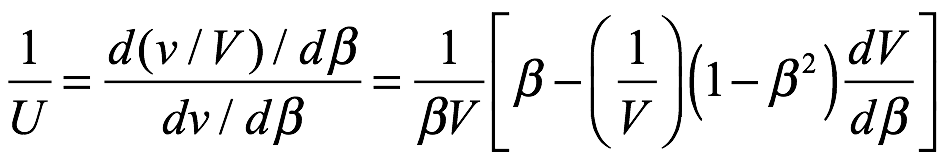 Ec. 3.15
Ec. 3.15
Pero ya hemos definido β = v/c, donde v es la velocidad del paquete de energía.
En nuestro desarrollo actual, esta es la velocidad de grupo U. Por lo tanto, U = βc.
Las ondas de fase en el espacio-tiempo
Esta es la sección final en el primer capítulo de la tesis de De Broglie. En esta sección se convierte en la geometría de tiempo de tiempo de Minkowski para demostrar que V = c / β. Su prueba es geométrica en el espacio bidimensional (x, xt). Nuestra prueba aquí evitará el espacio adicional que se requerirá para introducir la geometría de Minkowski. Sustituyendo el valor U = βc para la velocidad del grupo en (3.15), tenemos
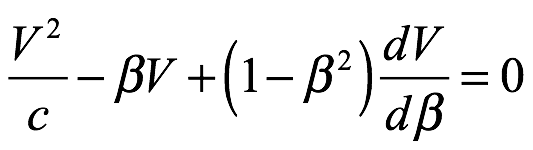 Ec. 3.16
Ec. 3.16
que es una ecuación diferencial no lineal para v. Elegimos no intentar una solución a esta ecuación. Sin embargo, podemos simplemente insertar la solución propuesta V = c / β para mostrar que es válida. De este modo, nos damos cuenta de que las dos ondas en la primera línea de (3.10) son ondas de fase a partir de las cuales se ha construido la parcela de energía, que se mueve a la velocidad del grupo U = βc.
La velocidad de la fase V de estas ondas de fase es el producto de la frecuencia ν y la longitud de onda λ de las ondas. Con ν de (3.5), entonces tenemos
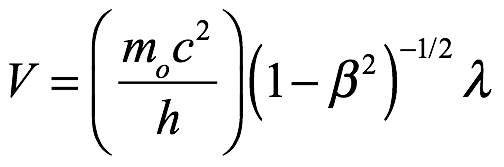 Ec. 3.17
Ec. 3.17
Con v = c / β, (3.17) se convierte en
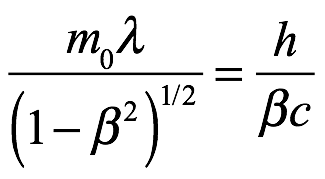 Ec. 3.18
Ec. 3.18
La velocidad de la parcela de energía es v = βc y la masa de la parcela en movimiento es
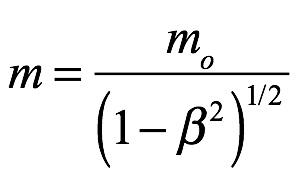 Ec. 3.19
Ec. 3.19
Por lo tanto, con el impulso 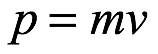 para la parcela de energía, (3.18) se convierte en
para la parcela de energía, (3.18) se convierte en
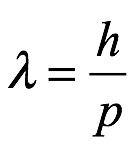 Ec. 3.20
Ec. 3.20
Esta es la longitud de onda de De Broglie asociada con una partícula en movimiento (la energía empaquetada).
En cap. 1 de la tesis de De Broglie, la ecuación.
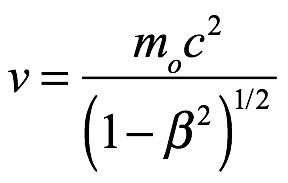 Ec. 3.21
Ec. 3.21
Aparece al final de la discusión sobre la relatividad. Con νλ = v = c / β, la ecuación (3.21) se convierte (3.18). Sin embargo, De Broglie no escribió esta ecuación en el formulario (3.20). Esto puede parecer curioso, ya que se considera que la principal contribución de De Broglie es el resultado expresado en la ecuación (3.20).
Conexiones
Después del desarrollo de su concepto de la onda de fase en el primer capítulo, los capítulos restantes de la tesis de De Broglie son esencialmente una reflexión sobre esta idea, a la luz de los principios fundamentales de la física teórica tan entendida en 1923. En cap. 2, De Broglie describió los principios variativos debido a Maupertuis, Hamilton y Jacobi, que formaron mecánicos analíticos, y el principio de refracción de la luz debido a Pierre de Fermat (1607-1665). La forma independiente del tiempo de Jacobi de la ecuación de Hamilton-Jacobi aparece en CHAP. 3 de la tesis. También en cap. 3, De Broglie abordó las condiciones de estabilidad cuántica para las trayectorias de partículas. Allí obtuvo las condiciones de estabilidad para el átomo de Bohr, llegando a la condición de que el impulso angular del electrón en una órbita de Bohr estable debe ser un múltiplo de 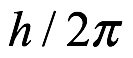 .
.
En el capítulo final de su tesis (cap. 7), De Broglie discutió el tema de la mecánica estadística. Se refirió a él como mecánica estadística cuántica, aunque no fue lo que actualmente conocemos como mecánica estadística cuántica, ya que la física del día simplemente aún no estaba lista para eso.
Defensa de la tesis
Cuando De Broglie defendió su tesis, sus argumentos dejaron una buena impresión en el Comité, aunque no todos sus miembros estaban convencidos de la validez de las ideas. Langevin fue su principal supervisor de tesis y apoyó a De Broglie y sus ideas. Por supuesto, Langevin había hablado con Einstein sobre las ideas de De Broglie antes de la fecha del examen. El interés positivo y de hecho de Einstein en las ideas de De Broglie convenció a Langevin para tomar una posición positiva. Einstein le preguntó a Langevin si tenía una copia de repuesto de la tesis. Afortunadamente, De Broglie había hecho tres copias, por lo que se podría enviar a Einstein.
Influencia
El próximo paso importante fue tomada por Erwin Schrödinger (1887-1961), quien comenzó con la forma independiente de la ecuación de Hamilton-Jacobi. En la tercera sección de su primer documento sobre la mecánica de ondas, Schrödinger señaló explícitamente la inspiración que había ganado de la tesis de De Broglie. Comentó específicamente en la idea de onda de fase que se había desarrollado de Broglie. Luego señaló que la principal diferencia entre los dos enfoques fue en el hecho de que De Broglie había desarrollado una imagen de ondas de viaje, mientras que consideraba eigensolutionsoluciones independientes de tiempo a una ecuación de onda.
El experimento de Davisson-Galler Clinton J.Davisson (1881-1958) fue frágil de marco a lo largo de su vida. Se graduó de la escuela secundaria a los 20 años y recibió una beca de un año a la Universidad de Chicago, donde pasó seis años, ya que sus estudios fueron interrumpidos por la falta ocasional de fondos. En Chicago, encontró la física "concisa y ordenada", y se inspiró en Millikan. Antes de terminar su licenciatura en Chicago, fue instructor a tiempo parcial en Física en la Universidad de Princeton, donde se le ocurrió la influencia de Owen Richardson (1879-1959). Se ganó su Ph.D. Bajo Richardson en Princeton en 1911 y, posteriormente, se casó con la hermana de Richardson, Charlotte, a quien había conocido cuando estaba visitando desde Inglaterra en 1911. Después de la luna de miel, Davisson se unió al Instituto de Tecnología de Carnegie como instructor. Pero la carga de enseñanza de 18 horas.
Lo dejó sin tiempo para la investigación, excepto el verano que pasó en el laboratorio de Cavendish con J.j. Thomson en 1913. Richardson regresó a Inglaterra en 1914 para convertirse en profesor de Piedra de Piedra de Física en King's College London. En 1917, Davisson no pudo alistarse en el ejército de los Estados Unidos debido a su fragilidad física. Tomó un permiso de ausencia de Carnegie Tech para hacer un trabajo relacionado con la guerra en Western Electric, que fue el brazo de ingeniería de la compañía estadounidense telefónica y telegráfica (AT&T). Esto más tarde se convertiría en laboratorios telefónicos de campana. Después de lawar, rechazó una promoción Atcarnegie Tech y aceptó una posición permanente en Western Electric. Los laboratorios telefónicos de Bell, luego en la ciudad de Nueva York, fue un centro de investigación industrial. El rápido crecimiento y capacidades del laboratorio industrial en el post guerra, una de las características clave del sistema científico estadounidense en desarrollo. La misión de un laboratorio industrial difería de la de un laboratorio académico o nacional en el sentido de que los proyectos emprendidos estaban directamente relacionados con las necesidades percibidas de la compañía que apoyaba al laboratorio. Sin embargo, el director del laboratorio podría usar su propio juicio para proporcionar la libertad. Necesario para continuar cualquier investigación que pareciera crítica por razones científicas, pero podría no estar obviamente relacionada directamente con ninguna pregunta industrial. En este momento, el director de la sección de investigación en Bell Laboratorieswas Harold D. Arnold (1883-1933). En marzo de 1917, se le asignó a Davisson a Asistente, Lester H. Germer (1896-1971), quien se acababa de graduarse de Cornell. Sin embargo, dos meses después, Germer se ofreció como voluntario para el servicio en el ejército y se convirtió en piloto en la sección de aviación del Cuerpo de Signas. Después de la guerra, después de tres semanas de descanso, Germer regresó a Bell Laboratories para trabajar con Davisson. Se les asignó la investigación de la emisión térmica en cátodos con recubrimiento de óxido bajo un bombardeo de iones positivos. Esto llevó a una investigación de la naturaleza de la emisión secundaria de cuadrículas y placas. Según el recuerdo posterior de Germer, este estudio se originó debido a una disputa de patente entre Arnold de Western Electric y Irving Langmuir (1881-1957) de General Electric. Sin embargo, el problema principal en la demanda, se ocupó de la comprensión de la física antes de 1913. Por lo tanto, los datos de 1920 fueron de poco valor [240, pp. 125, 130]. En 1920, Bell Laboratories inició un programa cooperativo para títulos avanzados con la Universidad de Columbia, que permitió a los elegidos elegir libremente su curso de estudio y reducir su tiempo de trabajo. Germer fue uno de los primeros en aprovechar esto, obteniendo un M.A. en 1922. En ese momento, Davisson estaba interesado en continuar con una investigación lateral de la emisión de electrones secundarios bajo el bombardeo de electrones. Esta Sideline fue animada por Arnold, quien suministró a un nuevo asistente, Charles Kunsman (1890-1970). Kunsman acababa de recibir un Ph.D. De la Universidad de California en Berkeley. Davisson y Kunsman descubrieron que el 1% de los electrones se volvieron hacia la pistola de electrones con prácticamente ninguna pérdida de energía.
Los electrones dispersos mostraron dos máximos. Uno de ellos estaba en la dirección del haz entrante y el otro estaba en ángulo. Este ángulo se vio afectado por la energía del haz entrante. Davisson quedó profundamente impresionado por este resultado. Señaló la similitud de la dispersión de electrones a la dispersión de partículas alfa que habían estado involucrando a Rutherford y su grupo en Manchester. En las propias palabras de Davisson: lo que estábamos intentando [...] fueron exploraciones atómicas similares a las de Sir Ernest Rutherford [...] en el que la sonda debe ser un electrón en lugar de una partícula alfa.
En 1921, Davisson y Kunsman presentaron un documento de dos columnas a la ciencia. Pero los experimentos posteriores produjeron resultados poco impresionantes y no fueron publicados. Kunsman abandonó la compañía a fines de 1923 y Davisson abandonó las investigaciones de dispersión. Germer se había enfermo, perdiendo 15 meses en el trabajo como resultado. Sin embargo, en octubre de 1924, fue devuelto al proyecto reemplazando a Kunsman. Los experimentos preliminares se llevaron a cabo para verificar el NewDatawith los datos de los experimentos anteriores realizados por Davisson y Kunsman. Luego, el 5 de febrero de 1925, se produjo el ahora famoso accidente. Una botella de aire líquido explotó mientras que el objetivo estaba a una temperatura alta. El tubo utilizado para el experimento se rompió y el objetivo se oxidó. Este no fue el primer accidente que ocurrió en el curso de estos experimentos, pero esta vez el objetivo no fue reemplazado. El óxido fue removido por vaporización junto con una capa del objetivo, después de un recocido prolongado en H2 y al vacío. El 6 de abril comenzaron de nuevo los experimentos. Al principio, los resultados no fueron diferentes a los obtenidos anteriormente. Pero luego, los 12 y 14 de mayo, en lugar de que se observó anteriormente el pico de desplazamiento único, hubo múltiples picos con grandes intensidades. Para comprender lo que podría haber ocurrido Davisson y Galler abrió el aparato y, con la ayuda del microscopista Francis F. Lucas (1885-1961), examinó la estructura del objetivo. En lugar de los muchos cristales microscópicos presentes anteriormente, observaron solo unos pocos cristales grandes. Los resultados, por lo tanto, vienen de la dispersión de los electrones por los cristales en lugar de los átomos. Afortunadamente, hubo un grupo en el laboratorio haciendo investigación sobre estructuras de cristal.
Davisson decidió que ahora deberían considerar dispersarse de un solo cristal con orientación conocida con respecto al haz de electrones. Debido a las demandas de otros experimentos en los laboratorios, un solo cristal no estaba disponible hasta abril de 1926, proporcionado por el metalúrgico de la compañía a Howard Reeve. Montaron el cristal para que se puedan cambiar los ángulos polares y azimutivos. Los resultados fueron decepcionantes. No hubo variación en el haz reflejado de la variación en el ángulo polar, y solo escasas dependencias del azimut. Arturo Russo señala que la difracción de electrones nunca se habría descubierto en Bell Laboratories si Davisson no necesitaba un descanso y regresó a Inglaterra con su esposa por una segunda luna de miel durante el verano de 1926. Según Charlotte Davisson, tenían la suerte de que su hermana y El cuñado de la Universidad de Princeton pudimos cuidar a los niños. Mientras que en Inglaterra, (Clinton), Davisson asistió a la reunión de Oxford de la Sociedad Británica para el Avance de la Ciencia. Allí escuchó una conferencia nacida en la nueva teoría cuántica y la naturaleza de la onda de la materia propuesta por De Broglie. Davisson había contactado previamente nacido para consejos sobre los cristales, ya que era un experto reconocido. En ese momento, nacido había sugerido a Davisson que los datos de dispersión de electrones podrían ser el resultado de fuerzas de diferentes planos en el cristal. Este primer contacto había dejado poca impresión en el nacido hasta que discutió el tema más tarde con Franck, quien elevó la posibilidad de olas de electrones tan propuesta por De Broglie. Nacido y Franck se dio cuenta de que los datos de Bell Laboratories pueden indicar la difracción de los olas electrónicas. Juntos, decidieron que el problema que buscaba y asignaba un nuevo estudiante graduado en el laboratorio de Franck, Walter Elsasser (1904-19 de 1991), al problema. En julio de 1925, Elsasser estaba listo para sugerir que los resultados de 1921 de Davisson y Kunsman podrían ser indicativos de la difracción de las olas electrónicas. Sin embargo, no estaba en condiciones de realizar ningún experimento de su propio [240, p. 143]. En su conferencia en Oxford, nacido citó el trabajo de De Broglie y los papeles de Schrödinger en la mecánica de ondas. Luego señaló que los experimentos de Davisson y Kunsman en 1921 habían proporcionado evidencia de la difracción de las olas de electrones. Esto dio lugar a una extensa discusión después de la conferencia, Franck, y Douglas Hartree (1897-1958) que brinda una introducción a los documentos de Schrödinger, que se ocupan de manera extensiva y directa con las ondas de la materia, los documentos de De Broglie y la nueva Matriz Mechanics debido a que nació, Heisenberg, y Jordania. Davisson normalmente había mantenido el mismo informado de los desarrollos en física, pero parece que aún no estaba al tanto de estos avances en la mecánica cuántica. Davisson prestados reimpresiones de The Schrödinger Papers y un diccionario alemán-inglés de Richardson para estudiar en el viaje de regreso a Nueva York. Cuando regresó a Bell Laboratories, tuvo una idea para el experimento, él y Galler deberían realizar. Davisson escribió a Richardson: Todavía estoy trabajando en Schrödinger y otros y creo que estoy empezando a tener una idea de cómo se trata. En particular, creo que sé que el tipo de experimento debemos hacer con nuestros aparatos de dispersión para probar la teoría. Arnold reconoció la importancia de la idea y asignó el ingeniero mecánico C. Calbick como asistente. Los experimentos comenzaron en diciembre de 1926. Los primeros resultados de acuerdo con la teoría se obtuvieron el 6 de enero de 1927 y se envió el primer anuncio a la Nature6 [67]. Los resultados también se presentaron en la reunión de la Sociedad Física Americana en Washingington en abril y Bell Laboratories Record Reportwas Publicado en abril. Papel de revisión lenta que apareció en la Revisión Física en diciembre de 1927. Al igual que en todos los experimentos anteriores, el aparato se montó dentro de un tubo de vidrio que contenía un alto vacío para evitar la absorción de los electrones.
La pistola electrónica G proporcionó un haz colimado de electrones dirigidos a la diana de níquel T, que podría girarse para colocar planos de celosía de cristal seleccionados en relación con el haz de electrones. El colector C fue una caja doble de Faraday con salida a un galvanómetro sensible, y fue similar al colector utilizado por Millikan. El ángulo del colector en relación con el haz de electrones se seleccionó girando el tubo y se midió en una escala en el lado opuesto al que se muestra en el dibujo. La escala es correcta para los datos 1921 (negros). La escala de los datos de 1927 (RED) se ha ajustado para que la diferencia entre los dos resultados se eliminen. La parcela es polar con un origen en el punto en el que el haz de electrones entrante golpea al objetivo. Un ángulo polar de cero se define por la dirección negativa del haz de electrones entrante. Los ángulos de haz de difractado positivos se centran en la dirección en el sentido de las agujas del reloj desde esto. El valor del componente radial es la relación de la intensidad del electrón difracted en el ángulo correspondiente a la intensidad de la viga entrante. La escala en nuestro dibujo, como en Davisson y la parcela de Germer, tiene un factor de 104. Esta es una indicación de la experiencia experimental. El mínimo relativo y el máximo de los datos de 1921 se encuentran en los ángulos polares de 65º y 75º, respectivamente. Davisson y Kunsman indicaban estos ángulos en su papel. Los hemos quitado para evitar el desorden. Saber que el relativemaxima, tan crucial para atraer la atención del grupo nacido, fue de 75º ayudará al lector a comprender la parcela polar. Los puntos rojos son aquellos en los 5º intervalos de lectura del documento de revisión física. Hubo muchos más puntos de datos en los gráficos en el papel de 1927 para indicar claramente la estructura que se puede:
 18.54.50.png)
En resumen como hemos visto en este apartado, De Broglie desarrolló sus ideas de manera lenta y cuidadosa antes de establecerlas en forma matemática. En última instancia, fue guiado por las matemáticas y la física, y su conocimiento de la física fue extenso, como está claro de su tesis. Su teorema de la armonía de fase se encuentra al comienzo de su idea de la representación de la onda de la fase de la parcela de energía, y llegó a este teorema a través de una relación entre las frecuencias que consideraba central para la teoría cuántica. Estos eran medidas audaces e inspiradas, pero no era el resultado de una inspiración repentina. Posteriormente, reflexionó sobre esto en términos de lo que se conocía en 1923. De particular importancia fue la conexión entre los principios de Hamilton y Fermat. De Broglie quería darle más sustancia a sus ideas y hacerlas más fáciles de presentarse. Aquí había una conexión matemática entre la trayectoria de partículas y el tratamiento geométrico de la luz. Pero De Broglie lo empujó más lejos, concluyendo que el impulso de partículas tenía que estar relacionado con la longitud de onda de la onda de fase. La importancia de esta relación es primaria, ya que proporciona algo que se puede medir en el laboratorio. En nuestra última sección, recogimos la historia de la medición, que fue la perfectamente serendípita. Esa historia involucró al laboratorio industrial estadounidense líder del día y también nos familiarizó con Schrödinger.
5.8 ¿Qué es un electron en 2022?
 20.09.39.png)
La ecuación de Dirac describe un electrón o positrón relativista que se mueve libremente como si no hubiera campos externos u otras partículas. Sin embargo, esta ecuación es importante para la descripción asintótica de las partículas que interactúan porque en el límite de tiempos grandes las partículas que interactúan tienden a comportarse como libres, siempre que aumente su separación mutua. Para obtener una interpretación mecánica cuántica consideramos la ecuación de Dirac como una ecuación de evolución en un espacio de Hilbert adecuado cuyos vectores se relacionan con los estados físicos mediante una interpretación estadística. Identificamos ciertos operadores autoadjuntos con observables físicos en correspondencia con la mecánica cuántica no relativista. Al escribir la ecuación de Dirac como un problema de valor inicial de la mecánica cuántica, llegamos a una interpretación de una partícula que, si se lleva demasiado lejos, conduce a algunas inconsistencias, incluso al nivel de las partículas libres.
Desde el descubrimiento de la ecuación de Dirac, hemos tenido una teoría satisfactoria de los electrones. La electrodinámica cuántica se desarrolló para poder describir la interacción del electrón con los fotones y esto condujo a una teoría que se ha verificado con una precisión de alrededor de una parte en 10^9. Examinemos el factor g para el momento dipolar magnético del electrón. La ecuación de Dirac predice que g = 2, pero una vez que se tienen en cuenta los fotones virtuales en la electrodinámica cuántica, encontramos que g − 2 = 11,596,521,817.8 × 10^−13 teóricamente, comparado con 11,596,521,807.3 × 10^−13 experimentalmente. Esto hace que la electrodinámica cuántica sea extraordinariamente precisa. En electrodinámica cuántica, el electrón es solo una fluctuación cuantificada en el campo de electrones. Esto explica por qué todos los electrones son idénticos. ¿Por qué debería uno mirar más allá de esta imagen? La respuesta es porque hay más en el mundo que electrodinámica. Hay otras interacciones, las fuerzas nucleares fuertes y débiles y la gravitación. Es posible incluir las interacciones fuertes y débiles en una generalización directa de la electrodinámica cuántica. Sin embargo, la gravedad no puede tratarse de la misma manera. Por esta razón, pasamos a la teoría de cuerdas. ¿Qué es la teoría de cuerdas y por qué debería uno estudiarla? Estas preguntas son las que siempre nos hacen quienes están fuera de la comunidad de la teoría de cuerdas. No importa quién haga la pregunta; podría ser un teórico de la materia condensada o un inspector de inmigración o alguien que conozca en un cóctel. En cada caso, la pregunta es siempre la misma. Lo que sigue es un intento de proporcionar algunas respuestas sobre la ruta para explicar qué es un electrón en la teoría de cuerdas. Para nosotros, normalmente un electrón es una partícula de espín 1/2 casi sin masa y con una carga eléctrica que se acopla al campo electromagnético que describe los fotones. Pero, ¿qué es realmente?
El Modelo Estándar (SM) de la física de partículas es quizás la teoría más exitosa jamás inventada. Nos proporciona explicaciones de la mayoría de los fenómenos de la naturaleza. Es una construcción que asume que las partículas puntuales se describen adecuadamente mediante una teoría de campo cuántico relativista de normalización. En él se encuentran las interacciones básicas de la naturaleza. Contiene tres generaciones de leptones y quarks coloreados junto con bosones gauge que transportan las fuerzas fundamentales de la naturaleza, gluones coloreados sin masa que median la fuerza fuerte, los fotones sin masa que son responsables de la interacción electromagnética y los bosones masivos W ± y Z que median la interacción débil. El color es como una carga eléctrica, pero solo lo llevan los quarks y los gluones. Además, existen escalares de Higgs que actúan para proporcionar la masa a aquellas partículas que son masivas. Toda la teoría se basa en el grupo de calibres SU(32) ⊗ SU(2) ⊗ U(1). Cada una de las interacciones fuertes, electromagnéticas y débiles están asociadas a una fuerza de acoplamiento.
Lo que el modelo estándar no proporciona es ninguna información sobre la materia oscura o la energía oscura, que constituyen alrededor del 27% y el 68% del Universo, respectivamente. Además, lo que entra en el SM parece bastante arbitrario. Por ejemplo, no hay una razón obvia por la que el grupo de calibre deba ser el que es, ni una razón obvia por la que deba haber tres generaciones. Sin embargo, hay una pista, a partir del conocimiento de las magnitudes de las tres fuerzas de acoplamiento, de que debería haber una imagen más profunda subyacente al SM. Los acoplamientos dependen de la energía de una manera especificada por las ecuaciones del grupo de renormalización. Si extrapolamos los tres acoplamientos a una escala de energía de alrededor de 10^15 GeV, se vuelven numéricamente similares. Si se hace una modesta extensión del SM para incluir la supersimetría, entonces esta coincidencia numérica se vuelve aún más fuerte. Entendemos que esto significa que existe algún tipo de unificación de estas tres interacciones a esa escala. Falta en el SM, y de hecho en cualquier extensión concebible del mismo, cualquier descripción de la interacción que controla el comportamiento de todo el Universo; gravitación.
A menudo se dice que la fuerza gravitacional es un caso especial y diferente a las otras fuerzas. Si bien es muy familiar, a nivel de partículas subatómicas individuales es mucho más débil que las otras fuerzas, en aproximadamente un factor de 10^39. Esto hace que sea difícil de estudiar, por lo que el mecanismo microscópico detrás de la gravitación aún no se comprende completamente. La única razón por la que notamos la gravitación es que, a diferencia de las otras fuerzas, es de naturaleza puramente atractiva. Las otras fuerzas pueden ser atractivas o repulsivas; es decir tienen cargas de ambos signos. En el electromagnetismo, las cargas similares se atraen y las cargas diferentes se repelen. Esa imagen es válida para todas las interacciones excepto la gravedad. La gravedad solo tiene un signo de carga. Entonces, aunque es débil a escala atómica, sus efectos se acumulan y se vuelven fácilmente observables para objetos grandes. Es por esa razón que la gravedad se observa más fácilmente en escalas de distancias astronómicas. Existe una excelente teoría de la gravitación que funciona al nivel clásico y es la teoría general de la relatividad de Einstein.
Sin embargo, la escala de unificación de 10^15 GeV está tan cerca de la escala de gravitación, la escala de Planck de 10^19 GeV, que ignorar la gravitación es seguramente un error.
En estas escalas de energía, la fuerza de los otros acoplamientos se vuelve similar a la de la gravitación. Y dado que difícilmente puede haber un conjunto de leyes para la gravitación y un conjunto diferente para todo lo demás, nos vemos impulsados ??a tratar de encontrar una imagen en la que se puedan explicar todas las interacciones a la vez. La teoría de supercuerdas es la única imagen conocida que incluye la gravitación que no sufre algún tipo de dificultad fatal. Tratar de incorporar la gravitación en una teoría cuántica de campo de partículas, un método que ha sido asombrosamente exitoso para las otras fuerzas, encuentra numerosos problemas. Para ello, se postula la existencia de un gravitón que transmite la fuerza gravitacional de forma similar a como un fotón transmite la fuerza electromagnética. Un gravitón visto como una partícula elemental debe no tener masa y tener un giro de dos en contraste con el fotón que no tiene masa y tiene un giro de uno. Es el hecho de que la gravedad sea universalmente atractiva lo que requiere que el gravitón tenga un giro de dos. Quizás la dificultad más grave que nadie ha encontrado jamás es el problema de la divergencia ultravioleta. En la teoría relativista de campos cuánticos, siempre se encuentran cantidades infinitas. Se puede pensar que esto está asociado con el hecho de que la energía propia de una partícula puntual es infinita. En las teorías sin gravitación, es posible controlar estos infinitos a través de un proceso conocido como renormalización. Si uno intenta construir una teoría cuántica de la gravedad siguiendo la misma ruta, es imposible deshacerse de estos infinitos sin violar algún principio físico esencial. Los principios con los que uno entra en conflicto son la causalidad, la idea de que ninguna información puede propagarse más rápido que la luz o la unitaridad, la idea de que la probabilidad de cualquier evento se encuentra en el rango de cero a uno inclusive. Estos dos principios son tan básicos para nuestra comprensión del universo que nos es imposible concebir una teoría que no satisfaga estas condiciones. Tal teoría se denomina irrenormalizable y, como teoría física fundamental, no tiene sentido. De hecho, es fácil ver por qué la gravedad es diferente. La idea de una partícula puntual en gravitación no existe realmente. Para ver por qué, considere un cuerpo esférico como la tierra. Para escapar de él, es necesario alcanzar una cierta velocidad, la velocidad de escape. Si un cuerpo de masa fija se vuelve más pequeño, su velocidad de escape aumenta. Si esta velocidad se vuelve igual a la velocidad de la luz, nada puede escapar del cuerpo. Un objeto así es un agujero negro. En relatividad general, esto es lo más cercano que se puede llegar a una partícula puntual. Los agujeros negros tienen un tamaño finito. Por ejemplo, si el Sol se encogiera para formar un agujero negro, entonces tendría un radio de alrededor de 3km. Uno podría pensar que esto requeriría una densidad que es imposible de obtener, pero de hecho para el Sol la densidad sería equivalente a aproximadamente la del núcleo. A medida que se consideran objetos más grandes, su densidad disminuye y si se piensa en la densidad de los agujeros negros en el centro de las galaxias, su densidad es similar a la del agua. La teoría de cuerdas más simple es la cuerda bosónica. Se denomina bosónico porque da como resultado objetos en el espacio-tiempo que son todos bosones. La cuerda bosónica no puede describir los fermiones y, por lo tanto, en el mejor de los casos es un modelo de juguete para la física realista. Uno reemplaza la "línea de mundo" de una partícula, una línea de tiempo unidimensional en el espacio-tiempo generado a medida que la partícula se mueve, con una superficie bidimensional con una dirección temporal y una dirección espacial. La dirección espacial puede ser un segmento de línea, la cuerda abierta, o un círculo, la cuerda cerrada. Por tanto, una cuerda es una superficie en el espacio-tiempo. Una cuerda abierta es aquella que tiene extremos espaciales que barren líneas en el espacio-tiempo. Una cuerda cerrada es un cilindro en el espacio-tiempo. Se puede considerar una cuerda como una generalización de una partícula. En la mecánica clásica, para describir el comportamiento de una partícula, uno construye una acción y usa sus ecuaciones de Euler-Lagrange como las ecuaciones de movimiento de las partículas. La acción es proporcional a la longitud adecuada de la línea de mundo. Extremizar la acción con posiciones iniciales y finales fijas produce las ecuaciones de movimiento de las partículas. Las interacciones entre partículas ahora pueden ocurrir, pero las interacciones deben concentrarse en puntos y, en la práctica, están restringidas por leyes de conservación que limitan la forma en que se observa que las partículas elementales interactúan. En el nivel clásico, estas interacciones deben introducirse a mano. En la teoría cuántica de campos, estas interacciones se introducen naturalmente como términos cúbicos o de orden superior que involucran los campos correspondientes a partículas particulares. Su tratamiento esquemático es como si las partículas tuvieran interacciones clásicas que implican tres o más vértices de puntos. La naturaleza de estas interacciones es bastante ad hoc y se rige por lo que se ha observado experimentalmente junto con algunos requisitos de coherencia, como la invariancia de calibre, la hermiticidad y la renormalización. Para describir el comportamiento de una cadena, se puede construir una acción similar. La acción es proporcional al área adecuada de la hoja del mundo de cuerdas. A diferencia de la teoría de partículas puntuales, todas las interacciones de las cuerdas están contenidas en esta acción. Mientras que las cuerdas libres se describen mediante tubos u hojas de mundos planas, no hay restricción en la topología de la hoja de mundos. La superficie que describe la cuerda puede tener agujeros o uniones donde se juntan las cuerdas. La acción de cadena puede describir cómo interactúan las cadenas sin tener que introducir ninguna suposición sobre cómo tienen lugar las interacciones. En principio, una cuerda puede vivir en d dimensiones de espacio-tiempo. Una cuerda se describe por si está abierta o cerrada, por su centro de movimiento de masa y cómo está vibrando. Si uno piensa en un punto en la superficie de la cuerda, puede moverse en dos direcciones en el plano de la cuerda, o en d - 2 direcciones perpendiculares a la superficie de la cuerda. El movimiento en la dirección de la cuerda es simplemente mover un punto en la hoja del mundo a otro y no corresponde a ningún cambio físico en la cuerda, tal como se describe. Dado que la superficie de la cuerda tiene una dirección similar al tiempo y una dirección espacial, todos los grados físicos de libertad corresponden a desplazamientos similares al espacio y, por lo tanto, son solo estas direcciones d-2 las que son movimientos físicos de la cuerda. Estas vibraciones en las direcciones d − 2 transversales a la cuerda deberían ser consideradas como ondas que viajan a lo largo de la cuerda de la misma manera que las vibraciones de una cuerda en un instrumento musical como una guitarra involucran ondas que causan el desplazamiento de la cuerda perpendicular a la cuerda. cadena en sí. Consideremos primero la cuerda bosónica cerrada. El espectro de estados de la cuerda consiste en una colección de excitaciones que se clasifican por su masa y otros números cuánticos. Los estados pueden no tener masa o tener masas en el orden de la escala de cuerdas. Dado que la escala de cuerdas es del orden de la escala de Planck, aproximadamente 10^19 GeV, las únicas excitaciones que son directamente observables son las que no tienen masa. Estos estados sin masa se pueden describir utilizando el mismo lenguaje que se usa para las partículas elementales. Eso es realmente porque en cualquier escala de distancia que podamos medir directamente, las cuerdas son invisiblemente pequeñas, del orden de la longitud de Planck, aproximadamente 10^-33 cm. Uno encuentra que el espectro de estados sin masa contiene tres tipos de objeto: algo con los números cuánticos de una partícula escalar, algo que es un poco como un fotón y un objeto con los números cuánticos esperados para un gravitón, el objeto que transmite la gravedad gravitacional. fuerza. Estas excitaciones sin masa son características universales de todas las teorías de cuerdas. Es este objeto parecido a un gravitón el que resulta más intrigante, ya que es algo que surge automáticamente de la teoría en lugar de algo que debe introducirse a mano. Es una pista de que la teoría de cuerdas realmente contiene gravitación.
Entonces uno puede preguntarse si la teoría de cuerdas es consistente mecánicamente cuántica. Este es un paso bastante no trivial que se impone a uno porque la teoría de cuerdas tiene una simetría clásica oculta, llamada simetría conforme. La simetría conforme es esencial para que la cuerda funcione correctamente. Sin embargo, los efectos cuánticos pueden provocar la ruptura de la simetría conforme. Este sería un estado de cosas indeseable. Resulta que los campos que producen teorías de cuerdas con simetría conforme ininterrumpida son precisamente aquellos que obedecen las ecuaciones clásicas de Einstein o las ecuaciones de Yang-Mills o para escalares una versión de la ecuación de onda. Esto indica una profunda relación entre las leyes físicas conocidas y la teoría de cuerdas. De hecho, se podría decir que estas leyes de la física, en lugar de ser postuladas, se han derivado de la simetría de la teoría de cuerdas. Existen algunas dificultades para promover las teorías de cuerdas bosónicas en modelos completamente sensibles de la física fundamental. La primera es que los efectos cuánticos dan como resultado que la cuerda tenga sentido solo si d = 26, que está bastante lejos del d = 4 que observamos. Un segundo problema es que no contienen fermiones. Un último problema es que todas las teorías de cuerdas bosónicas contienen un defecto fatal en forma de taquión. En su mayor parte, no necesitamos preocuparnos por estados masivos de cuerdas simplemente porque su masa es tan alta que no podemos observarlos. Una excepción a esto es lo que ocurre en la teoría de cuerdas bosónicas, y es que su espectro contiene un taquión, que es una partícula que tiene que moverse más rápido que la luz. Estos objetos, además de ser objetables debido a su conflicto con la causalidad, también tienden a indicar inestabilidades. Dado que sus masas son del orden de la escala de Planck, cualquier inestabilidad que señalen se regirá por una escala de tiempo del orden del tiempo de Planck de 10 a 43 segundos, en grave conflicto con la edad observada del universo. Sin embargo, hemos aprendido algunos datos interesantes. La primera es que se encuentra una teoría cuántica de campos de partículas sin masa como una versión de baja energía de la teoría de cuerdas. Todas las demás excitaciones de cuerdas no son directamente observables a escalas de energía a las que podemos acceder. Entre estas excitaciones de cuerdas, está el gravitón, por lo que tenemos el potencial de describir la gravedad utilizando la teoría de cuerdas. Uno podría preguntarse si tal teoría tiene el mismo tipo de problemas con los infinitos que la gravedad por sí misma. La respuesta es no. La teoría de cuerdas no tiene el tipo de divergencias que se encuentran en la teoría cuántica de campos. La razón es que cuando uno intenta calcular los tipos de cantidades que divergen en la teoría cuántica de campos, encontramos que no divergen en la teoría de cuerdas. Matemáticamente, esto se debe a que el efecto de todas las excitaciones masivas de la cuerda es acabar con esas divergencias. Hemos avanzado. Pero ahora necesitamos arreglar las dificultades encontradas en la teoría de cuerdas bosónicas. El remedio es la supersimetría y el resultado de incorporar supersimetría de esta manera produce la supercuerda. La idea básica de la supersimetría es introducir una simetría que intercambia bosones con fermiones. Por cada bosón, habrá un fermión. La supersimetría que nos interesa será un nuevo tipo de estructura en la hoja del mundo de cuerdas. Los grados físicos de libertad de la cuerda son las coordenadas espaciotemporales transversales a la hoja del mundo. Estos grados de libertad se comportan como bosones que viven en la hoja del mundo de cuerdas. Ahora, les presentamos a los socios algunos o todos estos grados de libertad. Estas son variables fermiónicas que se emparejan con variables bosónicas. Sorprendentemente, resulta que hay cinco formas diferentes de hacer esto de una manera consistente con la mecánica cuántica.
En cada caso, lo primero que descubrimos es que en lugar de ser consistente en solo 26 dimensiones del espacio-tiempo, la supercuerda solo es consistente en 10 dimensiones del espacio-tiempo. Lo segundo que descubrimos es que no hay taquiones en el espectro de la supercuerda. Por último, aunque hay estados de cuerda masivos como antes, todavía hay estados de cuerda sin masa, pero ahora, además de representar bosones, también hay fermiones. Por razones históricas, todos estos estados de cuerdas sin masa contienen gravedad, así como una colección de otros campos. Las cinco teorías de cuerdas diferentes generalmente se denominan teoría de cuerdas de Tipo IIA, teoría de cuerdas de Tipo IIB, teoría de cuerdas SO (32) y dos teorías de cuerdas heteróticas, SO (32) y E8 ⊗ E8. Contienen diferentes espectros de partículas sin masa. En cada caso, los campos son los mismos que los encontrados en varias teorías de supergravedad de diez dimensiones. La supergravedad es una extensión de la relatividad general supersimétrica. Las dos teorías de cuerdas de Tipo II están relacionadas con la supergravedad pura N = 2 y las otras teorías están relacionadas con las teorías de la supergravedad N = 1 acopladas a las teorías supersimétricas de Yang-Mills con los grupos de calibre SO (32) o E8 ⊗ E8. Cualquiera de estas teorías tiene el potencial de convertirse en modelos físicos realistas. Hay conexiones que permiten traducir cualquier problema en cualquiera de las teorías de cuerdas en cualquiera de las otras teorías de cuerdas. Estos se conocen como simetrías de dualidad. La imagen completa de las cinco teorías de cuerdas y la teoría de 11 dimensiones en la que se realizan las conexiones entre todas ellas se conoce como teoría-M. Si bien se sabe mucho sobre la teoría M, todavía es un trabajo en progreso. La teoría M es nuestra teoría candidata para todo. Sin embargo, parece estar muy lejos de algo que reconocemos. ¿Qué desearíamos de una teoría que describa todos los fenómenos que observamos? En primer lugar, debe ser una teoría con cuatro dimensiones de espacio-tiempo, no diez ni 11. En segundo lugar, a bajas energías, debe contener el SM y la gravitación. Una cosa de la que podemos estar bastante seguros, y es alrededor de la escala GUT de aproximadamente 10^16 GeV, nuestra teoría debe describirse mediante una teoría de cuatro dimensiones que tenga supersimetría. Entonces, asumiendo que comenzamos en 11 dimensiones del espacio-tiempo, necesitamos poder deshacernos de siete de ellas. Suponga que mira el tronco de un árbol de cerca. Lo que ves es el tronco con todo tipo de arrugas y defectos en su corteza. A medida que te alejas, el tronco parece hacerse cada vez más pequeño hasta que, cuando estás muy lejos, apenas puedes ver una línea vertical sin estructura. A distancias aún mayores, no ves nada. La lección es que si estás muy lejos de algo, realmente no lo notas. Es por este tipo de método que nos deshacemos de siete dimensiones del espacio-tiempo. Suponemos que son tan pequeños, que en la escala en la que existimos, simplemente no se notan. Imaginamos que estas direcciones del espacio están en la escala de unificación o más pequeñas. En cierto sentido, esto es derivable tanto en la teoría de cuerdas como en la teoría M. Sin embargo, las arrugas en el espacio en estas direcciones tienen una consecuencia física. La forma y el tamaño precisos de estas dimensiones adicionales se reflejan en la física de bajas energías por la existencia de escalares de luz o algunos campos nuevos llamados campos de módulos y axiones que describen relaciones entre las dimensiones pequeñas. Estas direcciones espaciales envueltas no necesitan ser suaves. Pueden tener picos y estos picos resultan ser interesantes. Si el espacio es puntiagudo, los campos de Yang-Mills aparecen en nuestra parte del espacio junto con sus supercompañeros fermiónicos. la naturaleza de los picos determina qué tipo de grupo de calibre tienen estos campos de Yang-Mills. Podría ser que el grupo indicador sea SU (5), el grupo indicador esperado en Grand Unified Theories. En este caso, los socios fermiónicos pueden ser multipletes de quarks y leptones. Al ajustar el punto, se puede generar el grupo de calibres de baja energía del SM, a saber, SU (3) ⊗ SU (2) ⊗ U (1). Los campos serán entonces exactamente los que se encuentran en el modelo estándar, es decir, quarks de colores asociados con el SU (3), W ± y Z asociados con el SU (2) y un fotón. Los supercompañeros fermiónicos son entonces los quarks, el electrón y los neutrinos. En este caso, un electrón es el resultado de un pico en las dimensiones extra ocultas. Uno podría preguntarse si existe algún tipo de límite en la complejidad del grupo de indicadores. La forma más complicada de picos resulta en el grupo de calibre E8. En cierto modo, esta observación contiene un milagro en el sentido de que a partir de una teoría que involucra un solo tipo de pico E8, uno encuentra una teoría con tres y solo tres generaciones de quarks y leptones, exactamente como parece ser el caso. Sin embargo, hay otra imagen que parece igualmente plausible. En la cuerda heterótica, se encuentran exactamente los mismos campos y supercompañeros de Yang-Mills como resultado de las oscilaciones de la cuerda. Entonces, para una cuerda heterótica, el electrón se produce como oscilaciones de la cuerda y no como resultado de ningún tipo particular de propiedades del espacio. ¿Cómo es posible que haya dos descripciones diferentes de lo mismo en la teoría de cuerdas? La respuesta es que existe una curiosa colección de simetrías que relacionan una imagen en la teoría de cuerdas o M con otra. Existe una traducción entre los fenómenos en la cuerda heterótica y los fenómenos en la teoría M. Da la casualidad de que lo que se describe por las puntas de las partes ocultas del espacio en la imagen de la teoría M es solo la excitación de la cuerda en la cuerda heterótica. No tiene sentido preguntar cuál tiene la razón. Ambos son explicaciones legítimas de lo que está sucediendo en la naturaleza. En este sentido, el fenómeno es exactamente como la dualidad onda-partícula en la mecánica cuántica. si decide pensar en un electrón o en una onda, depende de usted. Su comportamiento está descrito con precisión por la teoría de la mecánica cuántica, sin importar cómo quiera describirlo. La teoría M tiene ahora sus dualidades que permiten describir el electrón como una cosa en la imagen de 11 dimensiones y una cosa diferente en la imagen heterótica. Sin embargo, si hace preguntas sobre física que puede medir, obtendrá las mismas respuestas en cualquiera de las descripciones. Lo que hemos descrito aquí es cómo se debería pensar en un electrón, o en cualquier otra partícula elemental en la teoría de cuerdas. En la teoría cuántica de campos, todas estas son excitaciones de campo cuantificadas. Sin embargo, en la teoría de cuerdas, todo es mucho más geométrico. Existen muchas formas equivalentes de mirar la misma partícula que indican una enorme simetría oculta en la teoría de cuerdas que aún no se ha explorado por completo. Este es un gran desafío ya que las matemáticas de la teoría de cuerdas son difíciles. No obstante, la humanidad en el pasado se ha enfrentado a tales desafíos y ha alcanzado nuestra comprensión actual de la naturaleza del Universo. Incluso hace 50 años, habría sido imposible predecir cuánto se ha avanzado. Solo podemos esperar que nuestra civilización pueda continuar alentando y apoyando el progreso en este campo cuyo objetivo es comprender de qué estamos hechos en última instancia.
Referencias
[1] Kragh, Helge. (2021). Generaciones cuánticas : una historia de la física en el siglo XX / H. Kragh ; colaboración de José Alberto Pérez Díez ; tr. por Daniel Duque Campayo, Ana Granados Sanandrés, Manuel Sangüesa Lazcano..
[2] M. Planck, Vorlesungen Über Die Theorie Der Wärmestrahlungen (Barth, Leipzig, 1906,1913)
[3] A. Einstein, Annalen der Physik 17(6), 132 (1905)
[4] J.W. Gibbs, Elementary Principles in Statistical Mechanics (Yale University Press, Hartford 1902, reprint Dover, New York, 1960)
[5] M. Planck, Annalen der Physik 1, 99 (1900)
[6] Lord Rayleigh, London, Edinburgh, and Dublin Phil. Mag. J. Sci. 49, 539 (1900)
[7] M. Planck, Annalen der Physik 4(4), 553 (1901)
[8] P. Lenard, Annalen der Physik 8, 149 (1902)
[9] N. Bohr, Phil. Mag. 26, 1 (1913)
[10] R. Rhodes, The Making of the Atomic Bomb (Simon and Schuster, New York, 1986)
[11] J.L. Heilbron, Proceedings of the International School of Physics “Enrico Fermi” Course LVII, ed. by C. Weiner (Academic Press, New York, 1977)
[12] P. Forman, A. Hermann, Sommerfeld, Arnold (Johannes Wilhelm), Encyclopedia.com Complete
Dictionary of Scientific Biography (Charles Scribner’s Sons, 2008)
[13] S. Seth, Crafting the Quantum: Arnold Sommerfeld and the Practice of Theory, 1890–1926
(MIT Press, Cambridge, 2010)
[14] A. Einstein, A. Sommerfeld, Briefwechsel. Sechzig Briefe aus den goldenen Zeitalter der
modernen Physik, edited and annotated by A. Hermann (Basel-Stuttgart, 1968)