Texto universitario

_____________________________
CAPÍTULO 6. Espectroscopía y espectrometría de masas
6.1 Introducción
La Espectroscopía se ocupa de la producción, la medición e interpretación de los espectros derivados de la interacción de la radiación electromagnética con la materia. Existen muchos métodos espectroscópicos diferentes disponibles para resolver una amplia gama de problemas analíticos. Los métodos difieren con respecto a las especies a ser analizadas (tales como espectroscopía molecular o atómica), el tipo de interacción radiación-materia a ser monitoreada (tales como absorción, emisión, o de difracción), y la región del espectro electromagnético utilizado en el análisis. Los métodos espectroscópicos son muy informativos y ampliamente utilizados tanto para los análisis cuantitativos y cualitativos. Los métodos espectroscópicos basados en la absorción o emisión de radiación en el ultravioleta (UV), visible (Vis), infrarrojo (IR), y radio (resonancia magnética nuclear, RMN), los rangos de frecuencia son más comúnmente encontrado en los laboratorios tradicionales de análisis de alimentos[1]. Cada uno de estos métodos es distinto de modo que analiza diferentes tipos de transiciones moleculares o atómicas. La base de estas transiciones se explica en las siguientes secciones.
6.2 La Luz
6.2.1 Propiedades
La luz puede ser concebida como partículas de energía moviéndose a través del espacio con propiedades ondulatorias. Esta imagen de la luz sugiere que la energía asociada con un rayo de luz no se distribuye de forma continua a través del espacio, las ondas no solo fluctúan a lo largo de los campos magnético y eléctrico, sino que se concentran en paquetes discretos. Por lo tanto, la luz se dice que tiene una naturaleza dual: partículas y ondas. Fenómenos asociados con la propagación de la luz, tal como interferencia, difracción, y la refracción, son los que más sencillamente suelen ser explicados usando la teoría de las ondas de radiación electromagnética. Sin embargo, la interacción de la luz con la materia, que es la base de la espectroscopía de absorción y de emisión, puede ser mejor entendida en términos de la naturaleza particulada de la luz. La luz no es la única en poseer tanto propiedades ondulatorias como de partículas[2]. Por ejemplo, las partículas fundamentales de la materia, tales como electrones, protones, y neutrones, se sabe que presentan un comportamiento ondulatorio.
Las propiedades de onda de la radiación electromagnética se describen en términos de la frecuencia de onda, longitud de onda, y la amplitud. Una representación gráfica de una onda electromagnética en un plano polarizado- se muestra en la Fig. 6.1. La onda es polarizada en el plano en que los campos oscilantes eléctrico y magnético que componen la onda están cada uno limitado a un único plano. La frecuencia (ν, la letra minúscula griega Nu) de una onda se define como el número de oscilaciones que la onda hará en un punto dado por segundo. Este es el recíproco del periodo (p) de una onda, que es el tiempo en segundos requeridos para su sucesivo máximo que toma la onda de pasar a un punto fijo. La longitud de onda (λ) representa la distancia entre máximos sucesivos en cualquier onda dada. Las unidades utilizadas en longitudes de onda dependerán de la región de la radiación electromagnética utilizada en el análisis. Los datos espectroscópicos son reportados a veces con respecto al números de onda (? ), las cuales son longitudes de onda recíprocas en unidades de cm-1. Los números de onda observados con son de mayor frecuencia en la espectroscopia IR. La velocidad de propagación (?i) de una onda electromagnética, en unidades de distancia por segundo, en cualquier medio dado "i" se puede calcular tomando el producto de la frecuencia de la onda, en ciclos por segundo, y su longitud de onda en ese medio particular:
?i= νλi (6.1)
Donde:
?i= Velocidad de propagación en el medio i
ν = Frecuencia (de onda asociada)
λi = Longitud de onda en un medio i
La frecuencia de una onda electromagnética se determina por la fuente de radiación, y permanece constante a medida que la onda atraviesa diferentes medios. Sin embargo, la velocidad de propagación de una onda variará ligeramente dependiendo del medio a través del cual se propaga la luz. La longitud de onda de la radiación cambiará en proporción a los cambios de velocidad de la onda como se define por la ecuación. 6.1. la amplitud de la onda (A) representa la magnitud del vector eléctrico en los máximos de onda. La potencia radiante (P) y la intensidad radiante (I) de un haz de radiación son proporcionales al cuadrado de la amplitud de las ondas asociadas que componen esa radiación. La Figura 6.1 indica que las ondas electromagnéticas se componen de oscilación de los campos magnético y eléctrico, los cuales son mutuamente perpendiculares, en fase entre sí, y perpendiculares a la dirección de propagación de la onda.
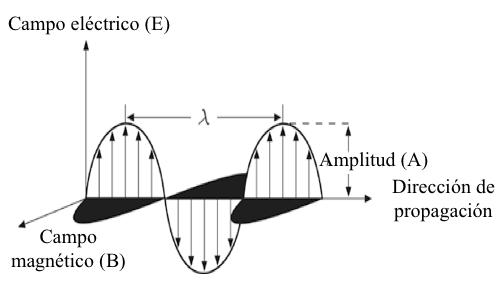
Figura 6.1 Representación de la propagación de la radiación electromagnética polarizada en un plano a lo largo del eje χ. Los campos eléctricos y magnéticos están en fase, perpendiculares entre sí y en dirección de la propagación.
En una especie de imagen, las ondas representan cambios en la intensidad de los respectivos campos con el tiempo en un lugar fijo o cambios en la intensidad de los respectivos campos con la distancia en un tiempo fijo. Los componentes eléctricos y magnéticos de las ondas son representados como una serie de vectores cuyas longitudes son proporcionales a la magnitud de los respectivos campos. El campo eléctrico oscilante es de la mayor importancia para los fenómenos de espectroscopia tales como la absorción, transmisión y refracción. Sin embargo, un campo puramente eléctrico, sin un campo magnético asociado, es imposible.
6.2.2 Terminología
La propagación de las ondas electromagnéticas se describe a menudo en términos de frentes de onda o trenes de ondas (Fig. 6.2). Un frente de onda representa el lugar geométrico de un conjunto de puntos, todos los cuales están en fase. Para un punto representando una fuente de luz, un anillo concéntrico que pasa a través de los máximos de los rayos de luz adyacentes representará un frente de onda. El anillo entero no necesita ser dibujado en todos los casos, de manera que los frentes de onda pueden representar planos de luz en los casos en que la observación se ha eliminado lo suficiente de la fuente puntual donde la superficie curva aparece plana. Los frentes de onda son más típicamente esquematizados mediante la conexión de máximos, mínimos, o ambos para los rayos adyacentes. Si se considera una longitud máxima para representar frentes de onda, entonces cada uno de los frentes de onda serán separados por una longitud de onda particular. Un tren de ondas, u onda de tren, se refiere a una serie de frentes de onda, todos los cuales están en fase, es decir, cada onda individual tendrá una amplitud máxima en la misma ubicación en el espacio. Un tren de ondas también puede ser representado por una serie de rayos de luz. Los rayos de luz se utilizan generalmente con referencia a la naturaleza corpuscular de la luz, que representa la ruta de fotones. Un tren de ondas indicaría que una serie de fotones, todos en fase, siguiendo el mismo camino.

Figura 6.2 Frentes de onda, trenes de ondas, y rayos.
6.2.3 Interferencia
Interferencia, es el término utilizado para describir la observación de cuándo dos o más trenes de ondas se cruzan entre sí, dando como resultado una onda instantánea, en el punto de intersección, cuya amplitud es la suma algebraica de las amplitudes de las ondas individuales en el punto de intersección. La ley que describe este comportamiento de las ondas es conocido como el principio de superposición. La superposición de ondas sinusoidales se ilustra en la Fig. 6.3. tenga en cuenta que en todos los casos, la amplitud efectiva de la onda percibida en el punto en cuestión es el efecto combinado de cada una de las ondas que cruza ese punto en cualquier instante dado. En la espectroscopía, la amplitud de más interés general es la que corresponde a la magnitud de la intensidad del campo eléctrico resultante. La Máxima interferencia constructiva de dos ondas se produce cuando las ondas están completamente en fase (es decir, los máximos de una onda se alinean con los máximos de la otra onda), mientras la Máxima interferencia destructiva se produce cuando las ondas son 180° fuera de fase (los máximos de una onda se alinean con los mínimos de la otra onda). Este concepto de interferencia es fundamental para la interpretación de los datos de difracción, lo que representa un segmento especializado de la espectroscopía cualitativa. Los fenómenos de interferencia también se utilizan ampliamente en el diseño de instrumentos espectroscópicos que requieren la dispersión o la selección de la radiación, tales como aquellos instrumentos que emplean monocromadores de rejilla o filtros de interferencia.

Figura 6.3 Interferencia mostrada por ondas idénticas (a) en fase, (b) 90° fuera de la fase, y (c)180° fuera de la fase.
Los fenómenos de interferencia son los más racionalizados considerando la naturaleza ondulatoria de la luz. Sin embargo, fenómenos tales como la absorción y la emisión de radiación se entienden más fácilmente considerando la naturaleza particulada de la luz. Las partículas de energía que se mueven a través del espacio con propiedades ondulatorias se llaman fotones. La energía de un fotón se puede definir en términos de la frecuencia de la onda con la que está asociado (Eq. 6.2):
E = h ν (6.2)
Donde:
E = La energía de un fotón
h = Constante de Planck
ν = Frecuencia (de onda asociada)
Esta relación indica que los fotones que componen la luz monocromática, que es una radiación electromagnética compuesta de ondas que tienen una sola frecuencia y longitud de onda, son todos de energía equivalente. Además, así como la frecuencia de una onda es una constante determinada por la fuente de radiación, la energía de los fotones asociados también será inmutable. El brillo de un haz de luz monocromática, cuando se expresa en términos de la naturaleza particulada de la luz, será el producto del flujo de fotones y la energía por fotón. El flujo de fotones se refiere al número de fotones que fluyen a través de una unidad de área perpendicular al haz por unidad de tiempo. De ello se desprende que para cambiar el brillo de un haz de luz monocromática se requerirá un cambio en el flujo de fotones. En la espectroscopía, la expresión brillo generalmente no se utiliza, sino más bien uno se refiere a la potencia radiante (P) o la intensidad radiante (I) de un haz de luz. La Potencia de radiación y la intensidad radiante menudo se utilizan como sinónimos para referirse a la cantidad de energía radiante que incide un área determinada por unidad de tiempo. En términos del Sistema Internacional de Unidades (SI) (tiempo, segundos; zona, metros, la energía, julios), potencia radiante es igual al número de julios de energía radiante que incide sobre 1m2 de área del detector por segundo. Las interrelaciones básicas de propiedades relacionadas de luz y un esquema general del espectro electromagnético se presentan en la Tabla 6.1 y la Fig. 6.4, Respectivamente.
Tabla 6.1 Propiedades de la luz

6.3 Estados de energía de la materia
6.3.1 Naturaleza cuántica de la materia
El contenido de energía de la materia se cuantifica. En consecuencia, el contenido de energía potencial o interna de un átomo o molécula no varía de manera continua, sino más bien en una serie de pasos discretos. Los átomos y moléculas, en condiciones normales, existen predominantemente en el estado fundamental, que es el estado de energía más bajo. Los átomos y moléculas en el estado fundamental pueden obtener energía, en cuyo caso presentarán una elevación a su estado inmediato de energía más alto, a estas transiciones se les refiere como estados excitados. La naturaleza cuántica de los átomos y moléculas pone limitaciones en los niveles de energía que están disponibles para estas especies. En consecuencia, habrá niveles de energía internos específicos “permitidos” para cada especie atómica o molecular. Los niveles de energía internos que no corresponden a un valor permitido para esa especie en particular son inalcanzables. El conjunto de niveles de energía disponibles para cualquier átomo o molécula dada será distinto para esa especie. Del mismo modo, los espacios de energía potencial entre los niveles de energía internos permitidos serán característicos de una especie. Por lo tanto, el conjunto de posibles espacios de energía para una especie pueden utilizarse cualitativamente como una huella digital distintiva. La espectroscopía de absorción y emisión cualitativa hacen uso de este fenómeno en el que estas técnicas estiman los espaciamientos relativos de la energía de un compuesto desconocido por la medición de las transiciones entre los niveles de energía permitidos.

Figura 6.4 El espectro electromagnético.
6.3.2 Niveles de energía electrónicos, vibracionales y rotacionales
La energía potencial relativa de un átomo o molécula corresponde a la diferencia de energía entre el estado de energía y la del estado fundamental. La figura 6.5 es un diagrama del nivel energético molecular parcial que representa los niveles de energía potencial de una molécula orgánica. El estado de energía más bajo en la figura, línea de fondo en negrita, representa el estado fundamental. Hay tres estados de energía electrónicos representados, cada uno con sus correspondientes niveles de energía de vibración y rotación. Cada uno de los estados electrónicos corresponden a un electrón dado encontrado en un orbital. Los electrones en orbitales diferentes son diferentes en su energía potencial. Cuando un electrón cambia de orbital, tal como cuando absorbe o emite un fotón de energía apropiada, se denomina una transición electrónica, ya que es el electrón el que cambió de nivel de energía. Sin embargo, cualquier cambio en la energía potencial de un electrón, por necesidad, da lugar a un cambio correspondiente en la energía potencial del átomo o molécula en la que el electrón esté asociado.
Los átomos son como moléculas en lo que respecta a que solo niveles específicos de energía están permitidos para los electrones atómicos. En consecuencia, un diagrama de niveles de energía de un átomo consistiría en una serie de niveles de energía electrónica. En contraste con las moléculas, los niveles de energía electrónica de los átomos no tienen niveles de vibración y rotación correspondientes y, por lo tanto, puede parecer menos complicado. Los niveles de energía atómica corresponden a capas permitidas de electrones (orbitales) y las correspondientes subcapas parciales (es decir, 1S, 2S, 2p, etc.). La magnitud de la diferencia de energía entre el estado fundamental y los primeros estados excitados para los electrones de valencia de los átomos y electrones de enlace de las moléculas es generalmente del mismo rango que el contenido de energía de los fotones asociados a la radiación UV y Vis.
Las líneas más anchas dentro de cada estado electrónico de la Fig. 6.5 representan las especies, los niveles de energía vibracional. Los átomos que comprenden una molécula están en constante movimiento, y vibración de muchas maneras. Sin embargo, en todos los casos, la energía asociada con este movimiento de vibración corresponde a los niveles de energía cuantificados definidos. Las diferencias de energía entre los niveles de energía de vibración vecinos son mucho más pequeñas que las existentes entre los niveles de energía electrónicos adyacentes. Por lo tanto, es común tener en cuenta que varios niveles de energía de vibración se superponen en cada uno de los niveles de energía electrónicos moleculares. Las diferencias de energía entre los niveles de energía de vibración permitidos son de la misma magnitud que la energía de los fotones asociados a la radiación en la región IR. Los niveles de energía vibracional no se superponen en un diagrama potencial atómico a nivel-energía, ya que este movimiento de vibración no existe en un solo átomo. A este respecto, el diagrama de energía potencial de un átomo es menos compleja que la de una molécula, el diagrama de niveles de energía atómica tiene menos niveles de energía.
La energía potencial de una molécula también se cuantifica en términos de la energía asociada con la rotación de la molécula alrededor de su centro de gravedad. Estos niveles de energía rotacionales son aún más estrechamente espaciados que los niveles de vibración correspondientes, tal como se representa por las líneas estrechas dentro de cada estado electrónico mostradas en la Fig. 6.5. Por lo tanto, es habitual considerar varios niveles de energía de rotación superpuestos en cada uno de los niveles permitidos de energía de vibración. Las separaciones de energía entre los niveles de energía de rotación son de la misma magnitud que la energía asociada con los fotones de la radiación de microondas. La espectroscopía de microondas no se usa comúnmente en los laboratorios de análisis de alimentos; sin embargo, la presencia de estos diferentes niveles de energía tendrá un impacto en el espectro observado en otras formas de espectroscopía. Similar a la situación de los niveles de energía vibracional, los niveles de energía de rotación no son de importancia para la espectroscopia atómica.
La espectroscopia hace uso del hecho de que cada una de estas energías asociadas se cuantifica, y que especies diferentes tendrán diferentes espacios de energía entre los respectivos niveles.

Figura 6.5 Diagrama de niveles de energía molecular parcial que representa tres estados electrónicos.
En resumen, la energía interna de un átomo se describe en términos de sus niveles de energía electrónicos, mientras que la energía interna de una molécula depende de su energía electrónica, vibracional, y de rotación. La forma algebraica es presentada a continuación:

La espectroscopía hace uso del hecho de que cada una de estas energías asociadas se cuantifica, y que especies diferentes tendrán diferentes espacios de energía entre los respectivos niveles.
6.3.3 Niveles de energía nuclear en campos magnéticos aplicados
La espectroscopía de RMN hace uso de otro tipo de nivel de energía cuantificable. Los niveles de energía de importancia para la espectroscopía de RMN difieren con respecto a los descritos anteriormente en los que solo son relevantes en presencia de un orbital externo en torno al campo magnético. La base de los niveles de energía observados puede ser racionalizados al considerar que los núcleos de algunos átomos se comportan como pequeños imanes de barra. Por lo tanto, cuando los átomos se colocan en un campo magnético, su momento magnético nuclear tendrá una orientación preferente, al igual que se comportaría un imán de barra. Los núcleos sensibles a la RMN de interés general para el analista de alimentos, tienen dos orientaciones permisibles. La diferencia de energía entre estas orientaciones permitidas depende de la intensidad de campo magnético efectivo que experimentan los núcleos. La intensidad de campo magnético efectivo en sí, dependerá de la fuerza del campo magnético aplicado y del ambiente químico que rodea los núcleos en cuestión. La intensidad del campo magnético aplicado será fijado por el espectroscopista, y es esencialmente equivalente para cada uno de los núcleos en el campo aplicado. Por lo tanto, las diferencias en las separaciones de energía de los núcleos de RMN sensibles dependerá únicamente de la identidad del núcleo y su entorno. En general, los espaciamientos de energía entre las orientaciones permisibles nucleares, bajo intensidades de campo magnéticos externos utilizables, son de la misma magnitud que la energía asociada con la radiación en el rango de frecuencia de radio.
6.4 Transiciones de nivel de energía en espectroscopía
6.4.1 Absorción de radiación
La absorción de radiación por un átomo o molécula es un proceso en el que la energía de un fotón de radiación electromagnética se transfiere a la especie absorbente. Cuando un átomo o molécula absorbe un fotón de luz, su energía interna se incrementa en una cantidad equivalente a la cantidad de energía en ese fotón particular. Por lo tanto, en el proceso de absorción, la especie va desde un estado de energía inferior a un estado excitado (de mayor energía).
En la mayoría de los casos, la especie se encuentra en el estado fundamental antes de la absorción. Dado que el proceso de absorción puede ser considerado cuantitativo (es decir, toda la energía del fotón se transfiere a la especie absorbente), el fotón absorbido debe tener un contenido de energía tal que coincida exactamente con la diferencia de energía entre los niveles de energía a través de los cuales se produce la transición. Este debe ser el caso debido a los niveles de energía cuantificados de la materia, como se indicó anteriormente. En consecuencia, si una parcela de energía del fotón frente a la absorbancia relativa de la radiación compuesta únicamente de fotones con esa energía, se observa un espectro de absorción característico, la forma de la cual se determina es por la capacidad de absorción relativa de fotones de diferentes energías. La absorción de un compuesto es una constante de proporcionalidad dependiente de longitud de onda que relaciona la concentración de especies absorbentes a su absorbancia medida experimentalmente en condiciones definidas. Un espectro de absorción representado que cubre una parte de la gama de la radiación UV se presenta en la Fig. 6.6. La variable independiente de un espectro de absorción se expresa más comúnmente en términos de las propiedades de las ondas (números de longitud de onda, frecuencia de onda) de la radiación, como en la Fig. 6.6, en lugar de la energía de los fotones asociados.
Varias transiciones moleculares resultantes de la absorción de fotones de diferente energías se muestran esquemáticamente en la Fig. 6.7, las transiciones ejemplificadas representan aquellos que pueden ser inducidas por absorción de UV, Vis, IR, y radiación de microondas. La figura también incluye transiciones en las que la molécula es excitada desde el estado fundamental a un estado electrónico excitado con un cambio simultáneo en sus niveles de energía vibracional o rotativos. Aunque no se muestra en la figura, la absorción de un fotón de energía apropiada también puede causar cambios simultáneos en los niveles de energía electrónicos, vibracionales y rotacionales. La capacidad de las moléculas para tener transiciones simultáneas entre los diferentes niveles de energía tiende a ampliar los picos en el espectro de absorción UV-Vis de moléculas en relación con los picos observados en el espectro de absorción de átomos. Esto es de esperarse al considerar que los niveles de energía de vibración y rotación están ausentes en un diagrama de niveles de energía atómica. Las transiciones representadas entre los niveles de energía de vibración, sin transiciones electrónicas asociadas, son inducidos por radiación en la región IR. Transiciones independientes entre los niveles de energía de rotación permitidos también se representan, esto resultante de la absorción de fotones de radiación de microondas. Un resumen de las transiciones relevantes para la espectroscopía de absorción atómica y molecular, incluyendo las correspondientes a la longitud de onda se presentan en la tabla 6.2.

Figura 6.6 Espectro de absorción de benceno 0.005 M en una solución de agua.

Figura 6.7 Diagrama parcial de los niveles de energía molecular incluyendo transiciones electrónicas, vibracionales y rotacionales.
Tabla 6.2 Regiones de longitud de onda, métodos espectroscópicos, y transiciones asociadas

6.4.2 Emisión de radiación
La emisión es esencialmente el inverso del proceso de absorción, ocurre cuando la energía de un átomo o molécula se libera en forma de un fotón de radiación. Una molécula elevada a un estado excitado permanecerá normalmente en el estado excitado durante un período muy corto de tiempo antes de retornar de nuevo a su estado fundamental. Hay varios procesos de retorno a través de los cuales una molécula excitada puede disipar la energía. El proceso de retorno a su nivel fundamental de energía más común, es que la molécula excitada disipe su energía a través de una serie de pequeños roses provocados por las colisiones con otras moléculas. La energía se convierte así en energía cinética, el resultado neto es la disipación de la energía en forma de calor. En condiciones normales, el calor disipado no es suficiente para afectar apreciablemente el sistema. En algunos casos, moléculas excitadas por la absorción de UV o Vis perderá una parte de su exceso de energía a través de la emisión de un fotón. Este proceso de emisión se refiere como cualquier fluorescencia o fosforescencia, dependiendo de la naturaleza del estado excitado. En la espectroscopía de fluorescencia molecular, los fotones emitidos desde las especies excitadas generalmente serán de menor energía y longitud de onda más larga que los fotones respectivos que fueron absorbidos en el proceso de excitación. La razón es que, en la mayoría de los casos, solo una fracción de la diferencia de energía entre los estados excitados y fundamentales se pierden en el proceso de emisión. La otra fracción del exceso de energía se disipa como calor durante la relajación vibracional. Este proceso se representa en la Fig. 6.8, que ilustra que las especies excitadas se someten a la relajación vibracional hasta el nivel de energía de vibración más bajo dentro del estado electrónico excitado, y después sufren una transición al estado electrónico fundamental a través de la emisión de un fotón. El fotón emitido tendrá una energía que es igual a la diferencia de energía entre el nivel de vibración más baja del estado electrónico excitado y el nivel del estado electrónico fundamental al que desciende. La molécula fluorescente puede descender a cualquiera de los niveles de vibración dentro del estado electrónico fundamental. Si la transición de fluorescencia es a un nivel vibracional excitado en el estado electrónico fundamental, entonces será volver rápidamente al estado fundamental (de menor nivel de energía) a través de la relajación vibracional. En otros casos, una especie excitada pueden ser de suficiente energía para iniciar algún tipo de fotoquímica que en última instancia conduce a una disminución de la energía potencial del sistema. En todos los casos, el proceso de relajación es impulsado por la tendencia de una especie de existir en su nivel de energía interna más baja permitida. El proceso de relajación que domina un sistema será el que minimiza el tiempo de vida del estado excitado. En condiciones normales, el proceso de relajación es tan rápido que la población de moléculas en el estado fundamental se percibe esencialmente sin cambios.

Figura 6.8 Diagrama parcial de los niveles de energía molecular incluyendo la absorción, relajación vibracional, y la relajación generando fluorescencia.
6.4.3 Población de los niveles de energía
El texto anterior discutió la existencia y naturaleza cuántica de los niveles de energía moleculares, atómicos y nucleares. Ahora es relevante preguntarnos cómo es probable que sean distribuidos entre sus niveles de energía permitidos, es decir, la población relativa de los diferentes niveles de energía en una población de partículas. Esto es importante tener en consideración debido a que la intensidad de la señal generada en un método espectroscópico es una función del número de partículas en el nivel de energía correspondientes al origen de la señal. Por ejemplo, cuando se hace espectroscopía tradicional de absorción molecular, es la medición de la excitación de las moléculas en el estado fundamental; cuando se hace la espectroscopía de emisión atómica, es la medición de los fotones emitidos por los átomos en un estado excitado. En el primer caso, la señal observada será una función del número de moléculas en estado fundamental; en este último caso, la señal será una función del número de moléculas en el estado excitado apropiado. Para una colección dada de partículas, la población relativa de los diferentes niveles de energía se describe mediante la distribución de Boltzmann. La distribución de Boltzmann es una distribución de probabilidad o distribución de frecuencias; cuando se aplica a un grupo de partículas, que describe el número medio de partículas que se encuentran en los diferentes niveles de energía disponibles para aquellas partículas (suponiendo que el sistema está en equilibrio térmico). La ley de distribución de Boltzmann se puede expresar de la siguiente manera:

p'= Probabilidad de encontrar partícula en un nivel de energía E´
p= Probabilidad de encontrar partícula en un nivel de energía E
E'= Energía correspondiente al nivel más alto de energía
E = Energía correspondiente al nivel más bajo de energía
k = Constante de Boltzmann
T = Temperatura absoluta
La ecuación indica que la fracción de moléculas en el estado superior de energía (E') disminuye exponencialmente con el aumento ΔE (es decir, E'-E). En la espectroscopia UV-Vis, la gran mayoría de las moléculas están en el estado fundamental ya que la diferencia de energía entre el estado fundamental y el primer estado excitado es relativamente grande. En resonancia magnética nuclear, las poblaciones de los dos estados de energía son casi idénticos debido a la relativamente pequeña diferencia de energía entre los estados de energía más bajos y más altos (el estado de energía inferior que está ligeramente más poblado). Estas relaciones son consistentes con la espectroscopia UV-Vis siendo significativamente más sensible que la espectroscopía de resonancia magnética nuclear. La ecuación ilustra también que el aumento de la temperatura de un sistema aumentará la fracción de moléculas en el estado de energía más alto. Esto es relevante para la espectroscopía de emisión atómica donde las moléculas en el estado excitado están emitiendo la señal detectada. A temperatura ambiental no hay suficientes átomos neutros en el estado excitado para hacer espectroscopía de emisión atómica. Sin embargo, como se procede a elevar la temperatura de la mezcla de analito, la fracción de átomos en el estado excitado aumenta hasta el punto de que la espectroscopía de emisión atómica se hace factible.
6.5 Resumen
Las ofertas de espectroscopía con la interacción de la radiación electromagnética con la materia. El análisis espectroquímico, una rama de la espectroscopía, abarca una amplia gama de técnicas utilizadas en laboratorios analíticos para el análisis cualitativo y cuantitativo de la composición química de los alimentos. Los métodos de análisis espectroquímicos comunes incluyen UV, Vis, y espectroscopia de absorción IR, espectroscopía de fluorescencia molecular, y espectroscopía de RMN. En cada uno de estos métodos, el analista intenta medir la cantidad de radiación absorbida o emitida por el analito. Todos estos métodos hacen uso de los hechos de que el contenido de energía de la materia se cuantifica y que los fotones de la radiación pueden ser absorbidos o emitidos por la materia si la energía asociada con el fotón es igual a la diferencia de energía para transiciones permitidas de esa especie. Los métodos anteriores difieren entre sí con respecto a las longitudes de onda de radiación utilizadas en el análisis o la naturaleza atómica vs. molecular del analito.
6.6 Preguntas de Estudio
1. ¿Qué fenómenos asociados con la luz se explican más fácilmente considerando la naturaleza ondulatoria de la luz? Explica estos fenómenos con base a su conocimiento de la interferencia.
2. ¿Qué fenómenos asociados con la luz se explican más fácilmente considerando la naturaleza particular de la luz? Explica estos fenómenos con base a su conocimiento de la naturaleza cuántica de la radiación electromagnética.
3. ¿Qué significa decir que el contenido de energía de la materia se cuantifica?
4. La absorción molecular de la radiación en los rangos UV-Vis resultado de las transiciones, ¿entre qué tipos de niveles de energía se encuentran?
5. La absorción molecular de la radiación en el rango IR resultado de las transiciones, ¿ entre qué tipos de niveles de energía se encuentra?
6. ¿Por qué es un campo magnético aplicado necesario para la espectroscopía de RMN?
7. ¿Cómo los niveles de energía permitidos de moléculas difieren de las de los átomos? Considera la respuesta con respecto al diagrama de niveles de energía representado en la Fig. 6.5.
8. En la espectroscopía de fluorescencia, ¿por qué la longitud de onda de la radiación emitida es más larga que la longitud de onda de la radiación utilizada para la excitación del analito?
Referencias
[1] Picó Y. 2012. Chemical Analysis of Food: Techniques and Applications. Academic Press Elsevier. First edition ISBN: 978-0-12-384862-8.
[2] Adapa P., Karunakarán C., Tabil L., Schoenau G. Potential applications of infrared and Raman Spectromicroscopy for agricultural biomass. Manuscript 1081. Agricultural Engineering International: the CIGR Journal XI. February, 2009.
Autores:
Eduardo Ochoa Hernández
Nicolás Zamudio Hernández
Lizbeth Guadalupe Villalon Magallan
Mónica Rico Reyes
Pedro Gallegos Facio
Gerardo Sánchez Fernández
Rogelio Ochoa Barragán