Texto universitario

_____________________________
Módulo 2. Hidrógeno
Módulo 2. Hidrógeno
 12.02.23.png)
2.1 Contexto del hidrógeno
El hidrógeno es un elemento químico con el símbolo H y número atómico 1. Con un peso atómico estándar de 1.008, el hidrógeno es el elemento más ligero de la tabla periódica. Su forma monoatómica (H) es la sustancia química más abundante en el universo y constituye aproximadamente el 75% de toda la masa bariónica. Las estrellas no remanentes están compuestas principalmente de hidrógeno en estado de plasma. El isótopo más común del hidrógeno, llamado protio (un nombre que rara vez se usa; símbolo 1H), tiene un protón y no tiene neutrones. Por definición en la ciencia de la cosmología física, "recombinación" se refiere a la época (es decir, la cronología del universo) en la que los electrones y protones cargados se unieron por primera vez para formar átomos de hidrógeno eléctricamente neutros[1]. La recombinación se produjo unos 378 000 años después del Big Bang (con un corrimiento al rojo de z = 1100).
La palabra "recombinación" es engañosa, ya que la teoría del Big Bang no postula que los protones y los electrones se hayan combinado antes; sin embargo, el término existe por razones históricas, ya que fue acuñado antes de que la hipótesis del Big Bang se convirtiera en la teoría principal de la creación del universo.
Inmediatamente después del Big Bang, el universo era un plasma denso y caliente de fotones, electrones y quarks: la época de Quark. A los 106s, el universo se había expandido y enfriado lo suficiente como para permitir la formación de protones: la época de Hadron. Este plasma era efectivamente opaco a la radiación electromagnética debido a la dispersión de Thomson por electrones libres, ya que el camino libre medio que cada fotón podía recorrer antes de encontrar un el electrón era muy corto. Este es el estado actual del interior del Sol. A medida que el universo se expandió, también se enfrió. Finalmente, este enfriamiento del universo se produjo hasta el punto de que se favoreció energéticamente la formación de hidrógeno neutro, y la fracción de electrones y protones libres en comparación con el hidrógeno neutro disminuyó a unas pocas partes.
La recombinación implica que los electrones se unan a los protones (núcleos de hidrógeno) para formar átomos de hidrógeno neutros. Debido a que la recombinación directa al estado fundamental (energía más baja) del hidrógeno es muy ineficiente, estos átomos de hidrógeno generalmente se forman con los electrones en un estado de alta energía, y los electrones pasan rápidamente a su estado de baja energía emitiendo fotones. Existen dos vías principales: desde el estado 2p mediante la emisión de un fotón Lyman-α (estos fotones casi siempre serán reabsorbidos por otro átomo de hidrógeno en su estado fundamental) o desde el estado 2s emitiendo dos fotones, que es muy lento.
Esta producción de fotones se conoce como desacoplamiento, que lleva a la recombinación a veces denominada desacoplamiento de fotones, pero la recombinación y el desacoplamiento de fotones son eventos distintos. Una vez que los fotones se desacoplaron de la materia, viajaron libremente por el universo sin interactuar con la materia y constituyen lo que hoy se observa como radiación de fondo de microondas cósmica (en ese sentido, la radiación cósmica de fondo es radiación infrarroja de cuerpo negro emitida cuando el universo estaba a una temperatura de unos 4000 K, desplazada al rojo por un factor de 1100 del espectro visible al espectro de microondas).
A temperatura y presión estándar, el hidrógeno es un gas diatómico incoloro, inodoro, insípido, no tóxico, no metálico y altamente combustible con la fórmula molecular H2. Dado que el hidrógeno forma fácilmente compuestos covalentes con la mayoría de los elementos no metálicos, la mayor parte del hidrógeno en la Tierra existe en formas moleculares como agua o compuestos orgánicos. El hidrógeno juega un papel particularmente importante en las reacciones ácido-base, porque la mayoría de ellas implican el intercambio de protones entre moléculas solubles. En los compuestos iónicos, el hidrógeno puede tomar la forma de una carga negativa (es decir, un anión) cuando se lo conoce como hidruro, o como una especie cargada positivamente (es decir, un catión) indicada por el símbolo H+. El catión de hidrógeno se escribe como si estuviera compuesto por un protón desnudo, pero, en realidad, los cationes de hidrógeno en compuestos iónicos son siempre más complejos. Como el único átomo neutro para el que la ecuación de Schrödinger se puede resolver analíticamente, el estudio de la energía y los enlaces del átomo de hidrógeno han jugado un papel clave en el desarrollo de la mecánica cuántica.
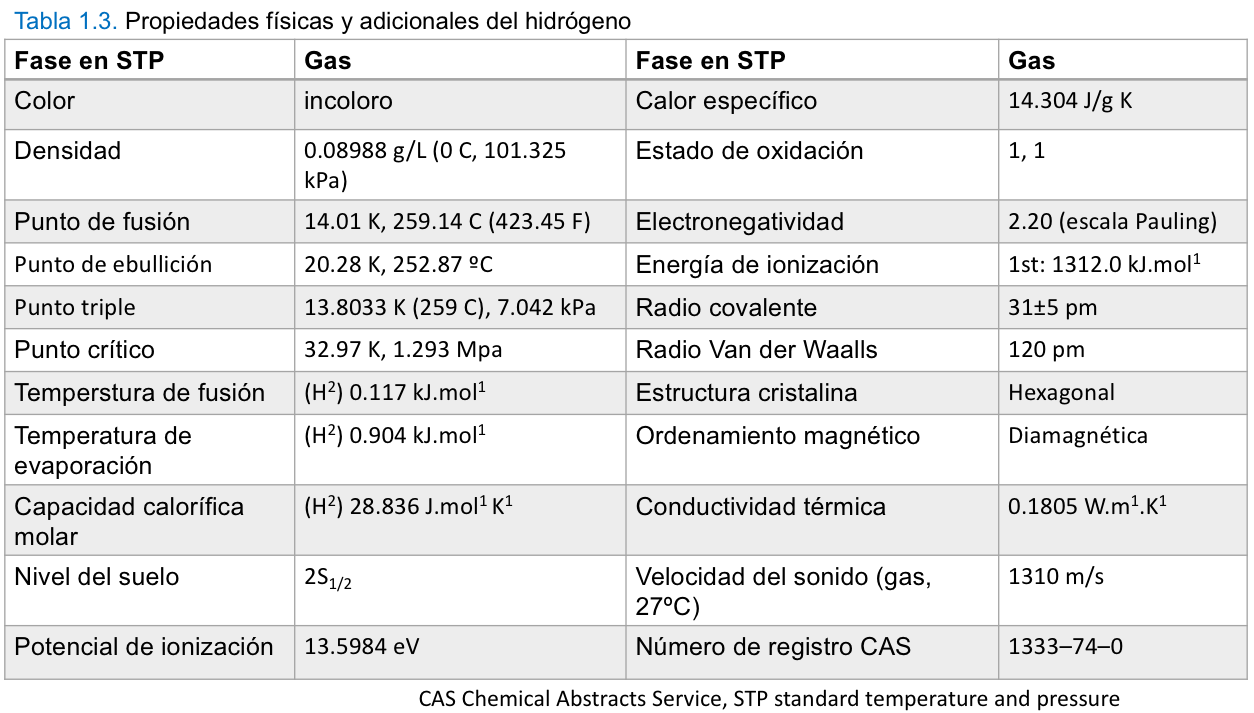
Propiedades físicas del hidrógeno (tiene dos isótopos): deuterio (D; peso atómico 2.01410222) y tritio (T; peso atómico 3.0160497). El tritio es radiactivo y emite rayos β de muy baja energía con una vida media de 12,26 años. Los isótopos tienen diferentes propiedades físicas pero propiedades químicas bastante similares. Solo se describe H, ya que el gas H2 es importante como medio energético en los sistemas de energía de hidrógeno.
Propiedades químicas. Una molécula de hidrógeno consta de dos átomos de hidrógeno. El hidrógeno es un gas incoloro e inodoro a temperatura ambiente y es el gas más liviano, siendo aproximadamente 1/14 de la densidad del aire. El hidrógeno licuado, que tiene un punto de ebullición muy bajo (-252,88 °C), ocupa mucho menos espacio, aproximadamente 1/700 veces más espacio que el hidrógeno gaseoso. Pero incluso en estado licuado, sigue siendo muy ligero. Su densidad es de aproximadamente 0,07 g/cm−3. El hidrógeno en sí es una molécula bastante estable con alta energía de enlace (435,99 kJmol−1), pero reacciona con muchos tipos diferentes de elementos para formar compuestos con ellos. Como es bien sabido, el hidrógeno reacciona fácilmente (se quema) con el oxígeno en una amplia gama de proporciones de mezcla y forma agua. Esto hace posible utilizar hidrógeno como medio energético. La mezcla de hidrógeno y aire puede encenderse con chispas de muy baja energía y se requieren precauciones de seguridad. La reactividad del hidrógeno con otros elementos se utiliza para diversas industrias químicas. Las reacciones del hidrógeno con algunos compuestos orgánicos se pueden utilizar para almacenar y transportar hidrógeno. Por ejemplo, al hacer reaccionar hidrógeno con benceno para producir ciclohexano, el hidrógeno se puede almacenar como ciclohexano, que luego se puede separar en benceno e hidrógeno. El amoníaco y los hidruros metálicos también son aplicaciones de la reactividad del hidrógeno para el almacenamiento. Las propiedades químicas más importantes del hidrógeno como medio energético son las relacionadas con la combustión.
2.1.1 Historia del hidrógeno
El hidrógeno es uno de los gases más poderosos que utilizamos: en nuestros automóviles, autobuses, lanzamientos espaciales de cohetes. Se ha descubierto que el hidrógeno es el elemento mejor, más antiguo y más limpio, y es la primera sustancia de la tabla periódica química. Hoy, estamos estudiando combustibles para el futuro. Pero en ciencia debemos estudiar el pasado para hacer plausible el mundo actual del combustible de hidrógeno y las pilas de combustible de hidrógeno[2]. Por tanto, veamos la historia de esta sustancia que se conoce como hidrógeno.
1776 el hidrógeno fue identificado por primera vez como un elemento distinto por el científico británico Henry Cavendish después de producir gas hidrógeno como resultado de la reacción entre el zinc metálico y el ácido clorhídrico. En una demostración a la Royal Society de Londres, Cavendish aplicó una chispa al gas hidrógeno, produciendo agua. Este descubrimiento lo llevó a descubrir más tarde que el agua (H2O) está hecha de hidrógeno y oxígeno.
1788 sobre la base de los descubrimientos de Cavendish, el químico francés Antoine Lavoisier le dio al hidrógeno su nombre, que se deriva de las palabras griegas hidro y genes, que significa "agua" y "nacido de".
1800 los científicos ingleses William Nicholson y Sir Anthony Carlisle descubrieron que la aplicación de una corriente eléctrica al agua producía gases de hidrógeno y oxígeno. Este proceso se denominó posteriormente "electrólisis".
1838 el químico suizo Christian Friedrich Schoenbein descubrió el efecto de la pila de combustible, que combina gases de hidrógeno y oxígeno para producir agua y una corriente eléctrica.
1845 Sir William Grove, un científico y juez inglés, demostró el descubrimiento de Schoenbein a escala práctica mediante la creación de una "batería de gas". Obtuvo el título de "Padre de la pila de combustible" por su logro.
1874 Julio Verne, un autor inglés, examinó proféticamente el uso potencial del hidrógeno como combustible en su popular obra de ficción titulada La isla misteriosa.
1889 Ludwig Mond y Charles Langer intentaron construir el primer dispositivo de pila de combustible utilizando aire y gas de carbón industrial. Llamaron al dispositivo una pila de combustible.
En la década de 1920, un ingeniero alemán, Rudolf Erren, convirtió los motores de combustión interna de camiones, autobuses y submarinos para utilizar hidrógeno o mezclas de hidrógeno. El científico británico y escritor marxista J.B.S. Haldane introdujo el concepto de hidrógeno renovable en su libro Daedalus o Science and the Future proponiendo que “habrá grandes centrales eléctricas de viento y el excedente de energía se utilizará para la descomposición electrolítica del agua en oxígeno e hidrógeno”.
1937 después de diez vuelos transatlánticos exitosos desde Alemania a Estados Unidos, el Hindenburg, un dirigible inflado con gas hidrógeno, se estrelló al aterrizar en Lakewood, Nueva Jersey, Estados Unidos. El misterio del accidente se resolvió en 1997 cuando un estudio concluyó que la explosión no se debió al gas hidrógeno, sino a una descarga eléctrica estática relacionada con el clima que encendió la cubierta exterior de lona de color plateado de la aeronave, que había sido tratada con los ingredientes clave del combustible sólido para cohetes.
1958 Los Estados Unidos formaron la Administración Nacional de Aeronáutica y del Espacio (NASA). El programa espacial de la NASA utiliza actualmente la mayor cantidad de hidrógeno líquido del mundo, principalmente para la propulsión de cohetes y como combustible para pilas de combustible.
1959 Francis T. Bacon de la Universidad de Cambridge en Inglaterra construyó la primera celda de combustible práctica de hidrógeno y aire. El sistema de 5 kilovatios (kW) alimentaba una máquina de soldar. Llamó a su diseño de pila de combustible "Bacon Cell". Más tarde ese año, Harry Karl Ihrig, un ingeniero de Allis-Chalmers Manufacturing Company, hizo una demostración del primer vehículo de pila de combustible: un tractor de 20 caballos de fuerza. Las pilas de combustible de hidrógeno, basadas en el diseño de Bacon, se han utilizado para generar electricidad, calor y agua a bordo para los astronautas a bordo de la famosa nave espacial Apollo y todas las misiones posteriores del transbordador espacial.
1970 El electroquímico John O'Mara Bockris acuñó el término "economía del hidrógeno" durante una discusión en el Centro Técnico de General Motors (GM) en Warren, Michigan, EE. UU. Más tarde publicó Energy: The Solar-Hydrogen Alternative, describiendo su economía de hidrógeno prevista en la que las ciudades de los Estados Unidos podrían recibir energía derivada del sol.
1972 El Gremlin de 1972, modificado por la Universidad de California en Los Ángeles, participó en el Concurso de diseño de vehículos urbanos de 1972 y ganó el primer premio por las emisiones de escape más bajas. Los estudiantes convirtieron el motor de combustión interna del Gremlin para que funcionara con hidrógeno suministrado desde un tanque a bordo.
1973 El embargo petrolero de la OPEP (Organización de Países Exportadores de Petróleo) y el consiguiente shock de suministro sugirieron que la era del petróleo barato había terminado y que el mundo necesitaba combustibles alternativos. Se inició el desarrollo de pilas de combustible de hidrógeno para aplicaciones comerciales convencionales.
1974 La National Science Foundation transfirió el Programa Federal de Investigación y Desarrollo de Hidrógeno al Departamento de Energía de los Estados Unidos. El profesor T. Nejat Veziroglu de la Universidad de Miami, Florida, organizó la conferencia The Hydrogen Economy Miami Energy (THEME), la primera conferencia internacional celebrada para discutir la energía del hidrógeno. Después de la conferencia, los científicos e ingenieros que asistieron formaron la Asociación Internacional de Energía de Hidrógeno (IAHE).
1974 La Agencia Internacional de Energía (AIE) se estableció en respuesta a las interrupciones del mercado mundial del petróleo. Las actividades de la AIE incluyeron la investigación y el desarrollo de tecnologías de energía de hidrógeno.
1988 La Oficina de Diseño Tupolev de la Unión Soviética convirtió con éxito un avión comercial TU-154 de 164 pasajeros para operar uno de los tres motores del avión con hidrógeno líquido. El vuelo inaugural duró 21 min.
1989 Se formó la Asociación Nacional del Hidrógeno (NHA) en los Estados Unidos con diez miembros. Hoy en día, la NHA tiene casi 100 miembros, incluidos representantes de las industrias automotriz y aeroespacial, gobiernos federales, estatales y locales, y proveedores de energía. También se creó el Comité Técnico de Tecnologías del Hidrógeno de la Organización Internacional de Normalización.
1990 Se puso en funcionamiento la primera planta de producción de hidrógeno con energía solar del mundo en Solar-Wasserstoff-Bayern, una instalación de investigación y pruebas en el sur de Alemania. El Congreso de los Estados Unidos aprobó la Ley Spark M. Matsunaga de Investigación, Desarrollo y Demostración del Hidrógeno (PL 101-566), que prescribió la formulación de un plan de gestión e implementación de cinco años para la investigación y el desarrollo del hidrógeno en los Estados Unidos. El Panel de Asesoramiento Técnico sobre Hidrógeno (HTAP) recibió el mandato de la Ley Matsunaga para garantizar la consulta y la coordinación de la investigación del hidrógeno. El trabajo en una celda de combustible de membrana de intercambio de protones (PEM) de 10 kW alimentada con metanol comenzó a través de una asociación que incluye a GM, el Laboratorio Nacional de Los Alamos, Dow Chemical Company y el desarrollador canadiense de celdas de combustible Ballard Power Systems.
1994 Daimler-Benz demostró su primer vehículo de pila de combustible New Electric CAR (NECAR-I) en una conferencia de prensa en Ulm, Alemania.
1997 El ingeniero jubilado de la NASA Addison Bain desafió la creencia de que el hidrógeno causó el accidente de Hindenburg. El hidrógeno, demostró Bain, no causó el catastrófico incendio sino la combinación de electricidad estática y material altamente inflamable en la piel de la aeronave. El fabricante de automóviles alemán Daimler-Benz y Ballard Power Systems anunciaron una colaboración de investigación de US $300 millones en pilas de combustible de hidrógeno para el transporte.
1998 Islandia presentó un plan para crear la primera economía del hidrógeno para 2030 con Daimler-Benz y Ballard Power Systems.
1999 La Royal Dutch/Shell Company se comprometió con el futuro del hidrógeno al formar una división de hidrógeno. Las primeras estaciones de servicio de hidrógeno de Europa se abrieron en las ciudades alemanas de Hamburgo y Múnich. Un consorcio de instituciones islandesas, encabezado por el grupo financiero New Business Venture Fund, se asoció con Royal Dutch/Shell Group, Daimler Chrysler (una fusión de Daimler-Benz y Chrysler) y Norsk Hydro para formar la Icelandic Hydrogen and Fuel Cell Company Ltd. para promover la economía del hidrógeno en Islandia.
2000 Ballard Power Systems presentó la primera celda de combustible PEM lista para producción del mundo para aplicaciones automotrices en el Salón del Automóvil de Detroit.
2003 El presidente George W. Bush anunció en su Discurso sobre el Estado de la Unión de 2003, una iniciativa de combustible de hidrógeno de 1,200 millones de dólares para desarrollar la tecnología de pilas de combustible de hidrógeno comercialmente viables, de modo que “el primer automóvil conducido por un niño nacido hoy podría ser impulsado por celdas de combustible".
2004 El secretario de Energía de los Estados Unidos, Spencer Abraham, anunció que se dedicarían más de 350 millones de dólares a proyectos de demostración de vehículos e investigación de hidrógeno. Esta asignación representó casi un tercio del compromiso de US $ 1,200 millones del presidente Bush para la investigación en tecnologías de hidrógeno y pilas de combustible. El financiamiento abarca más de 30 organizaciones líderes y más de 100 socios seleccionados a través de un proceso de revisión competitivo.
2004 El primer submarino del mundo con pilas de combustible fue sometido a pruebas en aguas profundas (marina alemana).
2005 Veintitrés estados de los Estados Unidos cuentan con iniciativas de hidrógeno.
Hoy – 2050: visión futura. En el futuro, el agua sustituirá a los combustibles fósiles como principal recurso de hidrógeno. El hidrógeno se distribuirá a través de redes nacionales de tuberías de transporte de hidrógeno y estaciones de servicio. La energía del hidrógeno y la energía de las pilas de combustible serán limpias, abundantes, confiables, asequibles y una parte integral de todos los sectores de la economía en todas las regiones industriales.
En la naturaleza, el hidrógeno se puede encontrar en gases volcánicos y algunos gases naturales como un elemento libre. El hidrógeno se crea mediante la descomposición de los hidrocarburos a través del calor, la acción del hidróxido de sodio o el hidróxido de potasio sobre la electrólisis de aluminio del agua, el vapor sobre el carbón calentado o el desplazamiento de los ácidos por los metales.
Como se mencionó anteriormente, el hidrógeno es el elemento más abundante en el universo. Los elementos más pesados se formaron a partir de hidrógeno u otros elementos que se hicieron a partir de hidrógeno. Aunque aproximadamente el 75% de la masa elemental del universo es hidrógeno, el elemento es relativamente raro en la Tierra. En una imagen tomada por el Telescopio Espacial Hubble, muestra una región de hidrógeno ionizado en la Galaxia del Triángulo[3].
 13.43.13.png)
2.2 Isótopos de hidrógeno
Los tres isótopos de hidrógeno más estables se producen de forma natural y cada uno tiene sus propios nombres:
1. Protio (0 neutrones, número atómico A = 1);
2. Deuterio (1 neutrón, número atómico A ¼ 2); y
3. Tritio (2 neutrones, número atómico A ¼ 3).
De hecho, el hidrógeno es el único elemento con nombres para sus isótopos comunes. El protio es el isótopo de hidrógeno más abundante. H4 a H7 son isótopos extremadamente inestables que se han elaborado en el laboratorio pero que no se ven en la naturaleza. Tanto el protio como el deuterio no son radiactivos. El tritio, sin embargo, se desintegra en helio-3 a través de la desintegración beta. El protio es el isótopo más común del elemento hidrógeno. Tiene un protón y un electrón, pero no neutrones.
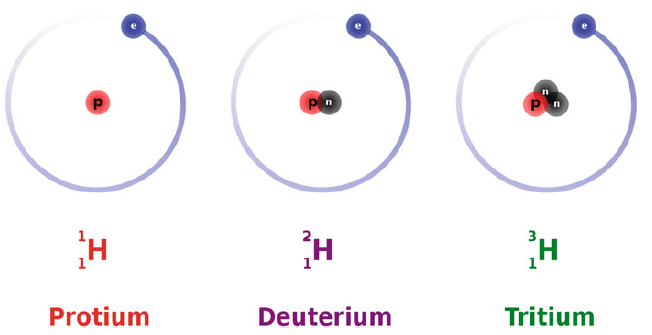
El hidrógeno es el único elemento cuyos isótopos tienen diferentes nombres que son de uso común en la actualidad. El isótopo H2 (o hidrógeno-2) generalmente se llama deuterio (D, contiene un protón, un neutrón y un electrón), mientras que el isótopo H3 (o hidrógeno-3) generalmente se llama tritio (T, contiene un protón, dos neutrones y un electrón). Los símbolos D y T (en lugar de H2 y H3) se utilizan a veces para el deuterio y el tritio, y debe tenerse en cuenta que la Unión Internacional de Química Pura y Aplicada (IUPAC) establece en el Libro Rojo de 2005 que el uso de D y T es muy común.
Como se mencionó anteriormente, H2 (masa atómica 2.01410177811 (12) u), el otro isótopo estable del hidrógeno, se conoce como deuterio y contiene un protón y un neutrón en su núcleo. El núcleo del deuterio se llama deuterón. El deuterio comprende 0,0026-0,0184% (por población, no por masa) de las muestras de hidrógeno en la Tierra, con el menor número tiende a encontrarse en muestras de gas hidrógeno y el mayor enriquecimiento (0,015% o 150 ppm) típico del agua del océano. El deuterio en la Tierra se ha enriquecido con respecto a su concentración inicial en el Big Bang y el sistema solar exterior (alrededor de 27 ppm, por fracción de átomo) y su concentración en las partes más antiguas de la Vía Láctea (alrededor de 23 ppm). Presumiblemente, la concentración diferencial de deuterio en el sistema solar interior se debe a la menor volatilidad del gas y los compuestos de deuterio, que enriquecen las fracciones de deuterio en los cometas y planetas expuestos a un calor significativo del Sol durante miles de millones de años de evolución del sistema solar[4].
El deuterio no es radiactivo y no representa un peligro de toxicidad significativo. El agua enriquecida en moléculas que incluyen deuterio en lugar de protio se llama agua pesada. El deuterio y sus compuestos se utilizan como marcador no radiactivo en experimentos químicos y en disolventes para espectroscopía 1H-NMR (resonancia magnética nuclear de hidrógeno-1). El agua pesada se utiliza como moderador de neutrones y refrigerante para reactores nucleares. El deuterio también es un combustible potencial para la fusión nuclear comercial. H3 (masa atómica 3.01604928199 (23) u) se conoce como tritio y contiene un protón y dos neutrones en su núcleo. Es radiactivo y se descompone en helio-3 mediante desintegración beta con una vida media de 12,32 años. Las trazas de tritio ocurren naturalmente debido a la interacción de los rayos cósmicos con los gases atmosféricos. También se ha liberado tritio durante las pruebas de armas nucleares. Se utiliza en armas de fusión termonuclear, como trazador en geoquímica de isótopos y en dispositivos especializados de iluminación autoamplificada.
El método más común para producir tritio es bombardear un isótopo natural de litio, el litio-6, con neutrones en un reactor nuclear. El tritio se utilizó una vez de forma rutinaria en experimentos de etiquetado químico y biológico como radiomarcaje, lo que se ha vuelto menos común en los últimos tiempos. La fusión nuclear D–T utiliza tritio como su principal reactivo, junto con deuterio, liberando energía a través de la pérdida de masa cuando los dos núcleos chocan y se fusionan a altas temperaturas.
El deuterio ionizado en un confinamiento electrostático inercial (IEC); se aprecia el característico resplandor rosado o rojizo que muestra el deuterio ionizado.
Tenga en cuenta que IEC es una rama de la investigación de reacciones de fusión que utiliza un campo eléctrico para calentar el plasma a condiciones de fusión. Los campos eléctricos pueden trabajar sobre partículas cargadas (ya sean iones o electrones), calentándolas a condiciones de fusión. Esto se hace típicamente en una esfera, con el material moviéndose radialmente hacia adentro, pero también se puede hacer en una geometría cilíndrica o de haz. El campo eléctrico se puede generar utilizando una rejilla de alambre o una nube de plasma no neutra.
Algunos otros datos sobre el hidrógeno se pueden resumir aquí:
• El hidrógeno es el elemento más ligero; el gas hidrógeno es tan ligero y difuso que el hidrógeno no combinado puede escapar de la atmósfera.
• El gas hidrógeno es una mezcla de dos formas moleculares, orto- y para-hidrógeno, que se diferencian por los espines de sus electrones y núcleos. El hidrógeno normal a temperatura ambiente consta de un 25% de parahidrógeno y un 75% de ortohidrógeno. La forma orto no se puede preparar en estado puro. Las dos formas de hidrógeno difieren en energía, por lo que sus propiedades físicas también difieren.
• El gas hidrógeno es extremadamente inflamable.
• El hidrógeno puede tener una carga negativa (H-) o una carga positiva (H+) en compuestos.
• Los compuestos de hidrógeno se denominan hidruros.
• El deuterio ionizado muestra un característico brillo rojizo o rosado.
2.3 Usos del hidrógeno
A primera vista, el hidrógeno es el elemento más simple que se sabe que existe. Un átomo de hidrógeno tiene un protón y un electrón. El hidrógeno tiene el contenido de energía más alto de cualquier combustible común en peso, pero el contenido de energía más bajo en volumen. Es el elemento más ligero y un gas a temperatura y presión normales. El hidrógeno es también el gas más abundante en el universo y la fuente de toda la energía que recibimos del Sol, y también es uno de los elementos más abundantes en la corteza terrestre. El hidrógeno como gas (H2), sin embargo, no existe naturalmente en la Tierra; se encuentra solo en forma compuesta. Combinado con oxígeno, forma agua (H2O). Combinado con el carbono, forma compuestos orgánicos como metano (CH4), carbón y petróleo. Se encuentra en todas las cosas en crecimiento de biomasa.
El hidrógeno es uno de los portadores de energía más prometedores para el futuro. Es un combustible de alta eficiencia y baja contaminación que se puede utilizar para el transporte, la calefacción y la generación de energía en lugares donde es difícil utilizar la electricidad.
El hidrógeno es una molécula muy importante con una enorme amplitud y extensión de aplicación y uso. Actualmente se utiliza en muchas industrias, desde la química y el refinado hasta la metalúrgica, el vidrio y la electrónica. El hidrógeno se utiliza principalmente como reactivo. Pero también se está utilizando como combustible en aplicaciones espaciales, como "eliminador de O2" en el tratamiento térmico de metales y por su baja viscosidad y densidad. Los usos actuales del hidrógeno en diversas industrias en todo el mundo debido al mayor uso de crudos más pesados ??que contienen mayores cantidades de azufre y nitrógeno y para cumplir con los estrictos estándares de emisión, la necesidad de hidrógeno está experimentando un crecimiento muy rápido en el petróleo.
Fabricación de hidrógeno
Con mucho, el proceso más importante para producir hidrógeno es el proceso de reformado con vapor. Las partes clave del proceso son la conversión de un material que contiene carbono en una mezcla de monóxido de carbono e hidrógeno seguido de la conversión de monóxido de carbono en dióxido de carbono y la producción de más hidrógeno.
En la actualidad, el hidrocarburo utilizado es generalmente metano u otros hidrocarburos ligeros obtenidos del gas natural o del petróleo y el carbón. Sin embargo, existe un interés creciente en el uso de biomasa, como se describe más adelante en esta sección.
Si se utilizan hidrocarburos, el gas o vapor se mezcla con un gran exceso de vapor y se pasa por tuberías que contienen óxido de níquel, que se reduce a níquel durante la reacción, y se apoya sobre alúmina, en un horno que funciona a altas temperaturas:
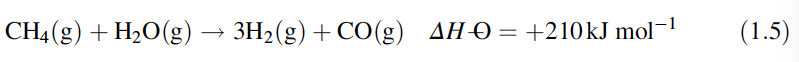
La reacción es endotérmica y se acompaña de un aumento de volumen. Por tanto, se ve favorecido por las altas temperaturas y las bajas presiones parciales. La reacción también se ve favorecida por una alta relación vapor: hidrocarburo. Esto aumenta el rendimiento pero aumenta los costos operativos (energéticos). La alta relación también ayuda a reducir la cantidad de carbono depositado, lo que reduce la eficiencia del catalizador. Se ha descubierto que la forma más eficaz de reducir la deposición de carbono es la impregnación del catalizador con carbonato de potasio.
En la segunda parte del proceso, la reacción de cambio, el monóxido de carbono se convierte en dióxido de carbono al reaccionar con vapor y así producir más hidrógeno:
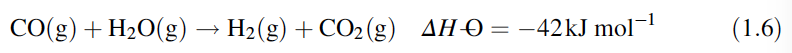
Esta reacción es significativamente exotérmica, por lo que las altas temperaturas en dióxido de carbono e hidrógeno se ven favorecidas por las bajas temperaturas. Esto es difícil de controlar debido al calor creado, y ha sido una práctica común separar la reacción de cambio en dos etapas: la mayor parte de la reacción se lleva a cabo a alrededor de 650 K sobre un catalizador de hierro, y la reacción de "pulido" llevada a cabo. alrededor de 450 K sobre un catalizador de cobre/zinc/alúmina.
A continuación, se eliminan el dióxido de carbono y cualquier resto de monóxido de carbono pasando los gases a través de un tamiz de zeolita. De vez en cuando, el recipiente que contiene el tamiz se saca de la corriente de gas y se lava con hidrógeno para desplazar el dióxido de carbono y regenerar el tamiz.
Para obtener una producción sostenible (es decir, cero emisiones de gases de efecto invernadero) de hidrógeno, el dióxido de carbono se captura y almacena o utiliza. Por lo tanto, en general, un mol de metano y dos moles de vapor se convierten teóricamente en cuatro moles de hidrógeno, aunque este rendimiento teórico no se logra ya que las reacciones no continúan hasta completarse:
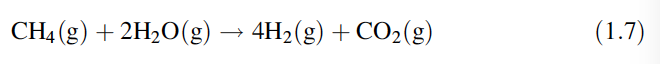
El hidrógeno se produce a partir de una variedad de materias primas, principalmente de gas natural, carbón o nafta. Las formas en que se obtiene el hidrógeno a partir de estas materias primas se tratan por separado. En algunos países (especialmente China), el metano y otros gases derivados del petróleo escasean y deben importarse. Esto ha provocado un cambio significativo en la elección del combustible utilizado en los reformadores de estos países. En lugar de un gas de hidrocarburo, se utiliza carbón, ya que es más fácil de conseguir.
Se están realizando investigaciones para ver si la biomasa en lugar del carbón o el petróleo se puede utilizar de forma eficaz para fabricar hidrógeno. Una de las cuestiones clave es minimizar la energía utilizada en la recogida de la biomasa y su transporte al lugar de uso, lo que puede implicar el uso de fuentes de energía no renovables. Los costos financieros y ambientales pueden ser altos, en relación con el ahorro al cambiar de recursos no renovables a biomasa.
Hay dos puntos clave a considerar:
(a) ¿Cómo fabricamos hidrógeno de la manera más "verde" posible?
El hidrógeno, como se discutió anteriormente, se produce a gran escala a partir de combustibles fósiles (gas natural, carbón), por lo que también produce dióxido de carbono, un gas de efecto invernadero que daña el medio ambiente. La ruta obvia para producir hidrógeno es invertir el proceso de quemar hidrógeno para producir agua, es decir, la electrólisis del agua. La ecuación general es la siguiente:
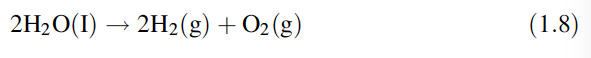
Sin embargo, esto requiere electricidad de las centrales eléctricas. Si la central eléctrica usa combustibles fósiles, frustra el propósito, es decir, producir un combustible sin la producción de dióxido de carbono. Otras formas de generación de energía, como la nuclear, la eólica y la geotérmica, no tienen esta desventaja, pero estas rutas no están fácilmente disponibles en muchos países. Independientemente de cómo se produzca el hidrógeno, existen problemas para distribuir el gas de manera económica pero respetuosa con el medio ambiente.
En la red de suministro existente, el hidrógeno se suministra a presión a las estaciones de repostaje de hidrógeno (HRS) mediante camiones cisterna especialmente construidos, ya sea como hidrógeno líquido o como hidrógeno gaseoso comprimido y luego se transfiere a recipientes de almacenamiento. Un método alternativo y más limpio es a través de una tubería y existen pequeñas redes de tuberías existentes, por ejemplo en Alemania, los Países Bajos y California, que se utilizan para suministrar hidrógeno directamente desde el punto de fabricación.
2.4 Hidrógeno Molecular
La Medicina del Hidrógeno Molecular, desde su nacimiento en 2007 hasta el estado actual y su perspectiva futura, abarcando experimentos con animales y numerosas aplicaciones clínicas. Los jugadores clave de la Medicina del Hidrógeno Molecular son el gas de hidrógeno y el agua de hidrógeno. El agua de hidrógeno es simplemente agua en la que se ha disuelto gas de hidrógeno, en otras palabras, una mezcla de moléculas de hidrógeno y moléculas de agua. Como se ha descubierto que el agua de hidrógeno exhibe casi los mismos efectos que el gas de hidrógeno, se cree que el componente efectivo real es la molécula de hidrógeno. Por lo general, el hidrógeno molecular es tan estable que no sufre ninguna reacción química con ninguna sustancia a temperatura ambiente y, por lo tanto, se considera un gas inerte para los organismos vivos. La Medicina del Hidrógeno Molecular tiene la particularidad de que, a diferencia de este sentido común de la bioquímica, tiene como objetivo investigar los efectos fisiológicos ejercidos por el hidrógeno molecular y sus posibles aplicaciones clínicas. Este es un nuevo campo de investigación que tiene profundas implicaciones para las ciencias de la vida.
2.4.1 Primeros informes de los efectos del hidrógeno
En el experimento de Dole (1975), se criaron ratones con cáncer de piel (carcinomas de células escamosas) en un entorno con 0.8 MPa (8 atm) de gas hidrógeno (y una cantidad adecuada de oxígeno) durante 2 semanas, lo que condujo a la reducción de las células cancerosas[5]. Este fue un descubrimiento importante que demostró los efectos fisiológicos del hidrógeno molecular, pero atrajo poca atención en ese momento y no se llevaron a cabo experimentos de seguimiento. La próxima vez que aparecieron impresos los efectos fisiológicos del gas hidrógeno fue 20 años después en un artículo titulado “Terapia de gas” en la columna “Daedalus” de la revista Nature[6]. Este artículo sugirió que la inhalación de gas hidrógeno podría eliminar rápidamente los radicales hidroxilo dentro del cuerpo, y que el hidrógeno debería ser completamente inofensivo para el cuerpo y excretarse por completo sin acumularse, y por lo tanto debería ser una terapia de gas ideal. El artículo establecía que el hidrógeno también podía disolverse en agua y tomarse por vía oral. Esto podría parecer una excelente predicción, pero de hecho, Jones aparentemente escribió el artículo como una ficción. Dédalo aparece en la mitología griega como un inventor que hizo alas para su hijo, Ícaro, y la columna lleva su nombre porque era ciencia ficción. Posteriormente, se intentó probar en la vida real. Criaron ratones con tumores hepáticos crónicos en un entorno con 0.7 MPa adicionales de gas hidrógeno (de un total de 0.8 MPa) durante dos semanas y descubrieron que el daño hepático en estos ratones se redujo notablemente[7]. Sin saberlo, redescubrieron la investigación pionera de Dole. Sin embargo, este redescubrimiento también fue olvidado, ya que no logró atraer ninguna atención. Después de realizar varios experimentos con células y animales, lograron desarrollar una mezcla de gas a alta presión que contenía hidrógeno y que es eficaz para la prevención de las enfermedades del buceo. Este puede considerarse como el primer logro relacionado con la Medicina del Hidrógeno Molecular.
2.4.2 Cómo comenzó la historia
La investigación del hidrógeno comenzó de una manera completamente diferente. En Japón, hubo personas, incluidos médicos, que trabajaron fervientemente para enfatizar los beneficios para la salud del “agua reducida” producida por la electrólisis del agua normal. Al leer las primeras publicaciones sobre el tema, se pueden ver numerosos ejemplos de sus beneficios. Los efectos mencionados incluyen una mejor forma física, una piel más suave, mejores síntomas de diabetes y efectos anticancerígenos. En todos los casos, sin embargo, hubo una falta de rigurosidad requerida para la investigación científica y, por lo tanto, estos informes no pueden tomarse al pie de la letra. No obstante, algunos de los datos generados no pueden descartarse por completo. Por ejemplo, se informó que el agua electrolizada suprimió el daño hepático oxidativo[8]. Como expertos en bioquímica y fisiología mitocondrial celular, estaban decididos a resolver el problema de esta “agua milagrosa” a través de experimentos cuidadosamente diseñados se abrió la línea de investigación.
Ohta había estado estudiando las funciones de las mitocondrias durante más de treinta años. Sin embargo, con la creciente conciencia de los efectos nocivos de las especies reactivas de oxígeno (ROS) generadas por las mitocondrias, incluido el envejecimiento y diversas enfermedades. En 2005, el grupo de investigación de Ohta comenzó a investigar el efecto del hidrógeno en ROS. Como procedimiento estándar en la investigación bioquímica, comenzaron desde el nivel celular y se trasladaron a los órganos y luego a todo el cuerpo. Comenzaron con experimentos con animales, con el objetivo de progresar a aplicaciones clínicas.
2.4.3 El hidrógeno molecular elimina selectivamente yhROS
No mucho después de comenzar sus experimentos celulares, el grupo Ohta se sorprendió por los notables efectos del hidrógeno. Más tarde, Ohta escribió lo siguiente: poco después de comenzar, sorprendió lo que vieron. Era el tercer día del experimento y, sin pensar, ¡Es asombroso! En los medios de cultivo con hidrógeno, las ROS inducidas en las células no causaron ningún daño. Las células estaban todas vivas. Fue un descubrimiento revolucionario… Este fue el primer experimento que demostró los efectos del hidrógeno en las células vivas. Estimular la formación de ROS en las células usando medicamentos generalmente hace que las células se encojan y adquieran una forma esférica a medida que su metabolismo se deteriora y eventualmente mueren. Sin embargo, cuando se disolvió hidrógeno en el medio de cultivo, las funciones de las células no se vieron afectadas y la muerte celular se redujo considerablemente. Las observaciones microscópicas mostraron que el hidrógeno podría ingresar a todos los orgánulos dentro de la célula (núcleo, citoplasma, mitocondrias, etc.), en contraste con los antioxidantes tradicionales que no pueden ingresar a la célula. Sus experimentos posteriores llevaron a otro descubrimiento importante: el efecto del hidrógeno era muy selectivo[9]. El efecto depurador del hidrógeno molecular en solución fue diferente para diferentes ROS; particularmente grande para •OH, mucho más pequeño para ONOO–, e insignificantemente pequeño para otras ROS. Esto implica que el H2 molecular elimina solo las ROS dañinas, dejando intactas otras ROS que desempeñan funciones importantes en la señalización celular. Este es un comportamiento completamente diferente al de los antioxidantes existentes (p. ej., la vitamina C), que eliminan indiscriminadamente tanto las ROS beneficiosas como los dañinos. Los efectos antioxidantes del H2 molecular también fueron confirmados por otros experimentos in vitro. El aumento de 8-OHdG (8-hidroxi-2’-desoxiguanosina) y 4-HNE (4-hidroxil-2-nonenal) producidos por peroxidación de ADN y lípidos, respectivamente, fueron suprimidos de manera efectiva por H2 molecular. Estos descubrimientos sugirieron fuertemente que el hidrógeno debería tener el potencial de actuar como un nuevo antioxidante. Luego, con aplicaciones clínicas en mente, procedieron a investigar los efectos del hidrógeno en la lesión por isquemia-reperfusión (I-R), en la que generalmente se produce un daño oxidativo grave. La lesión por I-R ocurre en circunstancias como el trasplante de órganos, donde la sangre (con oxígeno) se extrae temporalmente de un órgano y luego se vierte nuevamente en el órgano (reperfusión) después del trasplante. El suministro de oxígeno después de un período de privación de oxígeno da como resultado la producción de grandes cantidades de ROS. Este es un problema grave porque las ROS pueden causar daños en los órganos internos. En su experimento, se bloquearon las arterias cerebrales de ratas para detener el flujo sanguíneo durante 90 minutos, y se investigó el efecto del hidrógeno sobre el daño cerebral tras la reperfusión después de 30 minutos. Los resultados fueron reveladores. Al hacer que las ratas respiraran gas H2 al 2-4%, la región del cerebro dañada después de 1 día se redujo a casi la mitad. Además, las reducciones en la temperatura corporal, el peso corporal y la función motora como resultado de I-R tendieron a recuperarse después de 1 semana de tratamiento con hidrógeno. Por lo tanto, la inhalación de gas H2 suprimió el daño cerebral temporal debido a I-R, así como las enfermedades secundarias asociadas. Estos experimentos demostraron, sin lugar a dudas, que las moléculas de H2 administradas en forma de gas o disueltas en agua atravesaban los tejidos y las membranas biológicas y eliminaban de todo el organismo los radicales hidroxilo, las ROS más dañinas. Posteriormente, su grupo demostró mediante experimentos con ratones que la lesión por I-R hepática podría suprimirse mediante la inhalación de gas H2[10]. El procedimiento fue el siguiente: oclusión durante 90 min, reperfusión durante 180 min e inhalación de gas H2 (1-4%) durante los últimos 190 min. La vacuolización inducida por la lesión hepática fue suprimida de manera efectiva por el gas H2, mientras que el gas He no ejerció ningún efecto. La inhalación de gas H2 redujo el nivel de MDA (malondialdehído), un marcador de estrés oxidativo, a nivel casi normal (sin tratamiento I-R), y se muestra cambios concomitantes de ALT sérica (alanina aminotransferasa), un biomarcador de daño hepático. El efecto del H2 molecular fue muy similar. Estos experimentos fueron una gran sorpresa para la mayoría de los bioquímicos porque, debido a su alta estabilidad química, el gas H2 se consideraba un gas inerte para los organismos vivos, incluidos los humanos. Sin embargo, como sus experimentos estaban tan bien diseñados y cuidadosamente realizados, no había lugar para ninguna duda en el resultado. Y, de hecho, sus resultados fueron confirmados por numerosos experimentos de seguimiento. Así atrajo una amplia atención, y comenzó la investigación sobre las posibles aplicaciones clínicas del hidrógeno, ahora denominada “Medicina del hidrógeno molecular[11]”.
2.4.4 Efectos terapéuticos del hidrógeno
Las ROS están asociadas con enfermedades en casi todos los órganos, incluido el sistema nervioso central, los sistemas respiratorio, circulatorio, digestivo, vascular y endocrinológico, así como los ojos, la nariz, los dientes, los huesos y la piel. Se ha demostrado que el hidrógeno funciona eficazmente en muchas de estas situaciones. La medida en que el hidrógeno influye en los procesos fisiológicos ha superado las expectativas. Además, investigaciones posteriores demostraron que el hidrógeno no solo tiene efectos antioxidantes, sino también efectos antiinflamatorios, antialérgicos y de mejora metabólica. Aunque los avances médicos a menudo se enfrentan a un gran obstáculo para garantizar la seguridad al pasar de los ensayos clínicos en animales a los humanos, en el caso del hidrógeno, se han realizado ensayos clínicos debido a que no es dañino para el cuerpo humano.
2.4.5 Posibles efectos terapéuticos
Según los experimentos realizados en la Universidad de Keio, cuando el corazón de una rata se detuvo temporalmente y comenzó a funcionar nuevamente, la inhalación de gas H2 mejoró la tasa de supervivencia después de 7 días del 38% al 86 %. Las lesiones de los nervios craneales causadas por la isquemia se redujeron claramente[12]. Desde entonces, la Universidad de Keio ha estado organizando un ensayo clínico a gran escala en el que se administra gas H2 a pacientes con infarto agudo de miocardio (MCI) y pacientes que han sido resucitados después de un paro cardíaco. También se ha informado que el tipo de lesión I-R que se observa en los corazones, los pulmones y el intestino delgado de las ratas en el momento del trasplante de órganos se puede mejorar mediante la inhalación de gas H2. Se investiga la lesión por I-R inducida por trasplante en los pulmones de ratas. Los injertos se perfundieron y almacenaron en solución de dextrano a 4 ºC durante 6 h, y después del trasplante, los receptores se colocaron en cuatro atmósferas diferentes, 100 % O2, 98 % O2 + 2 % (N2, He, H2) durante la cirugía y 1 h después de la reperfusión[13]. La presión parcial de O2 y CO2 en la vena pulmonar del injerto 2 h después de la reperfusión. La función de intercambio de gases se deterioró en O2 y 98% O2 + 2% (N2, He), que mejoró significativamente en 98% O2 + 2% H2. La lesión por I-R fría se acompañó de un aumento de la expresión de varias citoquinas proinflamatorias, y este aumento se atenuó en una atmósfera de H2 al 2[14]%.
Se muestra que el tratamiento con H2 promueve la producción de proteínas antiapoptóticas Linfoma de células B-2 (Bcl-2) y Linfoma de células B-extra grande (Bcl-xl), mientras suprime el Bcl proapoptótico-2-proteína X asociada (Bax). Estos resultados indican claramente que el H2 molecular tiene efectos tanto antioxidantes como antiapoptóticos. Prosiguieron más adelante para demostrar que el H2 precargado antes de la obtención protegía eficazmente los injertos de las lesiones por I-R[15]. Se muestra el aumento de la expresión de HO-1 (hem oxigenasa 1) en el injerto de pulmón de rata causado por la carga de H2 antes del trasplante. Este aumento tiene una fuerte correlación inversa con el deterioro de la función de intercambio de gases después del trasplante. Debido a que HO-1 es una enzima antioxidante inducible, esto parece indicar que la inducción de HO-1 es uno de los mecanismos subyacentes a los efectos protectores de H2. Se informó que la inducción de HO-1 en injertos de riñón, corazón e hígado antes del trasplante proporcionó protección al injerto después de la reperfusión[16].
El proceso de lesión por I-R durante el trasplante de hígado en ratas se estudió con mayor detalle en la Universidad de Hokkaido[17]. Después de almacenamiento en frío durante 48 h en solución de la Universidad de Wisconsin (UW), el injerto se hizo circular con tampón oxigenado con o sin disolución de H2 a 37ºC en un aparato con el hígado de rata aislado y perfundido (IPRL). El estado del injerto después de una reperfusión de 90 minutos se examinó mediante varias mediciones diferentes. Los resultados obtenidos para los grupos H2(+) y H2(-) se comparan con los del grupo control (CT) sin almacenamiento en frío. Después del almacenamiento en frío, la resistencia de la vena porta (entrada), la presión de la vena porta necesaria para mantener el flujo del perfundido, aumentó notablemente en el grupo H2(-), lo que mejoró en el grupo H2(+). Los resultados indican que la alteración de la microcirculación hepática había progresado durante el almacenamiento en frío, pero se recuperó en gran medida en los primeros 30 minutos de reperfusión en el grupo H2(+).
Se muestra la función hepática después de una reperfusión de 90 minutos; tasa de consumo de oxígeno, una medida de la actividad metabólica (viabilidad), que refleja la función respiratoria de las mitocondrias, y producción de bilis, una de las principales funciones del hígado. Ambas funciones se deterioraron durante el almacenamiento en frío, pero mejoraron hasta cierto punto durante la reperfusión en el grupo H2(+). Posteriormente, se probó el efecto del H2 con hígado de rata extraído después de una muerte cardíaca (injerto DCD[18]). Se había descartado el uso de injertos DCD debido a la rápida progresión de las lesiones provocadas por la isquemia caliente, pero se descubrió que el tratamiento con H2 posterior a la reperfusión mejoraba el deterioro en gran medida. La resistencia de la vena porta fue casi la misma que en los injertos de muerte encefálica (DBD), seguido de un aumento lento a partir de entonces. La mejora de la viabilidad y la producción de bilis también fue muy similar a la de los injertos DBD, aunque un poco más pequeña. Este es un descubrimiento muy importante para la medicina de trasplantes porque podría abrir la posibilidad de permitir el uso de injertos DCD.
Nota: Análisis estadístico de datos experimentales: el valor p en el campo de la biología y la medicina, a diferencia de la física y la química, los experimentos/observaciones a menudo brindan una gran cantidad de datos dispersos. Incluso después de eliminar todos los errores concebibles, queda una dispersión de origen no especificado, debido a la inevitable diferencia entre los sujetos, incluidos tanto los innatos como los ambientales. Por lo tanto, en biología y medicina es de vital importancia evaluar críticamente la calidad de los datos, que se expresa mediante dos parámetros: desviación estándar y valor p. La dispersión de datos está representada por la desviación estándar, generalmente inscrita como barras de error en presentaciones gráficas. Está definido por σ [(X1 av)2 + . . .. + (Xn av)2]/(n )}(1/2) onde Xav es el valor promedio, Xav X1 + X2 + . . . + Xn)/n, siendo n el número total de mediciones.
Debido a la presencia de errores, cualquier conclusión que se extraiga de tales experimentos/observaciones debe hacerse con algunas reservas. Para decirlo de manera más precisa, cualquier enunciado debe presentarse con la probabilidad de que el enunciado sea erróneo debido a la dispersión de datos de origen no especificado. Este es el valor p (valor de probabilidad). El valor p se puede calcular a partir de la teoría de la estadística, suponiendo que la dispersión es de origen aleatorio y que el tamaño de la muestra (número de sujetos) es suficientemente grande. Para explicar el valor p, examinemos el caso de si la administración de agua H2 en lugar de agua normal aumenta la concentración de H2 en la sangre. Para ello, preparamos dos grupos, el grupo HW (Agua H2) (A) y el grupo control (B), cada uno formado por n sujetos, y obtenemos dos conjuntos de datos medidos {Ai} y {Bj}, con valores medios Aav y Bav, respectivamente. Construyamos un nuevo conjunto de datos que consta de n diferencias Ai-Bj de una combinación arbitraria de i y j, que escribimos {Xk}. Si el origen de la dispersión es aleatorio y el tamaño de la muestra es lo suficientemente grande, la distribución de Xk se acerca a la función en forma de campana bien definida llamada función de distribución normal, cuyo centro está ubicado en Xav = av -Bav, el ancho está determinado por σ, y el área bajo la curva se normaliza a la unidad. Lo que deseamos saber es si la diferencia entre Aav y Bav es estadísticamente significativa. Para responder a esta pregunta en términos cuantitativos, consideramos el caso hipotético donde no hay diferencia entre los dos grupos (hipótesis nula). Aunque el valor medio debería ser cero por definición, existe una probabilidad finita de que obtengamos un valor distinto de cero “erróneamente” debido a la distribución de errores. En el caso de la hipótesis nula, la probabilidad de obtener valores promedio “erróneamente” mayores que Aav-Bav. Este es el valor p. Si este valor es menor que un valor preestablecido, digamos p = 0.05, entonces podemos decir que la probabilidad de que Xav accidentalmente se convierta en cero es lo suficientemente pequeña. En otras palabras, la diferencia entre {Ai} y {Bj} es estadísticamente significativo. El nivel de significancia Pc es fijado por el juicio del investigador, dependiendo del problema en consideración; para problemas biológicos y médicos, Pc generalmente se establece en 0.05 o 0.01. El valor p ciertamente es útil para juzgar la calidad de los datos, pero no “prueba” nada. Solo proporciona una medida de probabilidad de la corrección de la declaración, calculada bajo un conjunto de suposiciones y aproximaciones, a menudo excluyendo otros factores posibles. Como se afirma con frecuencia, se debe tener precaución contra la mala interpretación y el mal uso del valor p.
Lesiones debidas a glaucoma y cirugía de cataratas
El hidrógeno puede suprimir las lesiones de la retina causadas por la presión ocular alta en el glaucoma[19]. En un experimento con ratas, se descubrió que las lesiones I-R inducidas por el aumento temporal de la presión ocular se suprimían mediante la administración de una solución salina saturada con hidrógeno (solución salina H2 saturada). La muerte celular normalmente comienza 1 día después, avanza en 1 semana y produce atrofia retiniana, pero la administración de hidrógeno redujo significativamente la muerte celular. En otros lugares, los experimentos en ratas y conejos han demostrado que las gotas para los ojos que contienen agua hidrogenada (agua H2) también son efectivas para las cataratas y la retinopatía diabética. Posteriormente, se ha demostrado que el daño endotelial de la córnea que a veces ocurre en la cirugía de cataratas podría mitigarse mediante el uso de una solución de irrigación disuelta en H2. Como medida del daño corneal, se midió la opacidad 5 h después de la cirugía. La supresión del daño en el grupo H2 es evidente. El mecanismo de acción del H2 en este caso se atribuye a la eliminación de los radicales hidroxilo producidos por ultrasonidos en el proceso de facoemulsificación[20].
Enfermedades cutáneas eritematosas agudas
Se ha informado de enfermedades cutáneas eritematosas agudas[21]. Son una enfermedad aterradora en la que de repente se desarrollan manchas rojas en todo el cuerpo, lo que provoca síntomas graves con el tiempo e incluso la muerte. Se dice que la causa de la enfermedad es un rápido aumento de ROS debido a un desencadenante desconocido. Cuando un paciente fue recibido en el hospital, se encontraba en estado muy grave. Muchos eritemas y úlceras eran evidentes en su rostro, y no podía abrir el ojo izquierdo y apenas podía abrir la boca. El tratamiento con solución salina H2 mediante infusión por goteo condujo a una recuperación notable: pudo abrir los ojos y la boca 3 días después, y 6 días después el eritema desapareció y el paciente se curó por completo. Aunque este es ciertamente un estudio de caso único, es un ejemplo de los efectos dramáticos que la administración de hidrógeno podría proporcionar en algunos casos.
Peritonitis a sepsis
Se ha demostrado la eficacia del agua H2 en la peritonitis aguda en ratas. La peritonitis es la inflamación del peritoneo, una membrana que recubre la pared del abdomen, en la mayoría de los casos causada por una infección bacteriana por ruptura del apéndice, úlcera estomacal o intestinos perforados[22]. Sin un tratamiento inmediato, la peritonitis aguda puede provocar una infección potencialmente mortal en todo el cuerpo, por ejemplo, una sepsis letal.
Cicatrización de heridas
La cicatrización de heridas es una secuencia de eventos ordenados: hemostasia, inflamación, proliferación y maduración del tejido, un proceso para recuperar la estructura y función de los tejidos perdidos por una lesión. Se ha examinado el efecto del agua H2 en la cicatrización de heridas en un modelo de rata[23]. Se creó una herida por escisión circular de espesor completo de 3.5 mm de diámetro en el centro de la región oral palatina y se tomaron fotografías los días 0, 1, 2, 3 y 7 después de la operación para medir el área de la herida. Durante el período, se administró agua destilada para el grupo de control (CL) y agua H2 de concentración inicial de 5–7 ppm para el grupo de agua H2, cada uno compuesto por 12 ratas[24]. La cicatrización se acelera claramente en el grupo de agua H2.
Lesiones por radiación
La radiación ejerce acciones de cara de Jano hacia los cuerpos vivos: se utiliza para radioterapia donde los tumores malignos se eliminan por irradiación, mientras que ejerce varios efectos perjudiciales sobre los tejidos y órganos vivos. Incluso actúa como cancerígeno. Las lesiones inducidas por radiación se dividen en dos categorías; efectos directos en los que la radiación energética golpea biomoléculas en su camino y las destruye, y efectos indirectos mediados por ROS producidos por la radiación, más específicamente por el aumento de la producción de radicales hidroxilo. Dado este conocimiento, los efectos radioprotectores del hidrógeno molecular podrían esperarse naturalmente. La tasa de supervivencia de los ratones después de la radiación de rayos γ en todo el cuerpo aumentó significativamente con la administración previa de agua H2[25]. Las mediciones bioquímicas revelaron el proceso que sigue a la irradiación local del corazón. Se muestra el aumento de MDA y 8-OHdG producido por la modificación oxidativa de los lípidos de la membrana y el ADN, respectivamente. Tenga en cuenta que el aumento fue suprimido por la administración previa de agua H2. El agua H2 también mejoró el daño en el sistema de defensa antioxidante endógeno. Las actividades de SOD (superóxido dismutasa, antioxidante enzimático) y GSH (glutatión, antioxidante no enzimático) se deterioraron por la radiación, pero el deterioro se suprimió mediante la administración previa de agua H2.
Síndrome metabólico
El hidrógeno es eficaz para el tratamiento del síndrome metabólico. El síndrome metabólico es un nombre colectivo que se le da a las enfermedades relacionadas con el estilo de vida, como la diabetes, la dislipidemia y la hipertensión causadas por el sobrepeso y la obesidad, el estilo de vida inactivo y la resistencia a la insulina. Cuando estas enfermedades avanzan, existe el riesgo de enfermedades arterioscleróticas como angina, deterioro cognitivo leve (DCL) y accidentes cerebrovasculares; por lo tanto, se requieren medidas de precaución. Se ha administrado continuamente 900 ml/día de agua H2 a pacientes diabéticos durante 8 semanas y estudiaron el efecto y encontraron que el metabolismo de las grasas y los azúcares mejoró, lo que llevó a un alivio significativo de los síntomas[26]. Esta es la primera publicación en la que se investigó el efecto del hidrógeno en la clínica. Varios otros detalles han salido a la luz en los experimentos con animales posteriores. Los ratones obesos tratados con agua H2 saturada durante 3 meses mostraron una clara reducción de peso, una reducción del 40% en la grasa del hígado y, además, una disminución de los niveles de glucosa en sangre, insulina y grasa neutra. También hay informes que sugieren que el agua H2 reduce la disfunción eréctil y la retinopatía en los ojos, que son complicaciones de la diabetes[27]. Más tarde también se confirmó que el agua H2 suprime la absorción de ácidos grasos por parte del hígado, la inflamación y la incidencia de cáncer. El hidrógeno también actúa en los vasos sanguíneos. La manifestación de la arteriosclerosis se suprimió en ratones modelo con arteriosclerosis que fueron tratados mediante la administración oral de agua H2. Mientras que la arteriosclerosis comienza debido a lesiones en el endotelio (membrana en contacto con la sangre) que ocurren debido a la deposición de colesterol, grasa, calcio y otras sustancias en los vasos sanguíneos, el agua H2 ayudó a reducir la cantidad de estos depósitos[28]. A partir de entonces, se realizaron muchos experimentos con animales y se realizaron estudios clínicos de los efectos del agua H2 sobre la hepatitis y la diabetes en el Instituto Metropolitano de Gerontología de Tokio, la Universidad de Okayama y la Universidad de Tohoku, Japón. También se espera que el agua H2 sea eficaz para mejorar el estado general del síndrome metabólico.
Deterioros cerebrales
El hidrógeno funciona bien para reducir el deterioro funcional en el sistema nervioso, específicamente en el cerebro. No solo ayuda a aliviar las lesiones por I-R y las lesiones causadas por una intervención quirúrgica en el cerebro, sino que también se sabe que el hidrógeno influye en funciones de orden superior en el cerebro. Mantener a los ratones encerrados en un espacio estrecho durante un período prolongado provoca un deterioro de la memoria debido al estrés oxidativo; pero cuando se administra agua H2, en lugar de agua ordinaria, durante este tiempo, se alivia el deterioro y también se reduce el deterioro de la función de aprendizaje[29]. También hay resultados de experimentos con animales que sugieren que el agua H2 es eficaz contra la enfermedad de Alzheimer[30]. Estos hallazgos sugieren que el hidrógeno funciona de manera efectiva en el hipocampo, que es responsable de la memoria y las funciones cognitivas del cerebro. En la práctica, un experimento realizado más tarde con ratones estimulados por el envejecimiento mostró que proporcionar agua H2 suprimió el avance del deterioro de la memoria, así como la atrofia del hipocampo debido a la muerte de las células nerviosas[31]. En la enfermedad de Parkinson, la muerte de las neuronas (células nerviosas) que controlan el movimiento conduce a la atrofia cerebral y al movimiento inestable y, en casos extremos, la enfermedad también implica un deterioro intelectual. La enfermedad de Parkinson se manifiesta debido a la falta de secreción de dopamina en el cerebro, cuya causa no está clara. Incluso la levodopa, una terapia sintomática proporcionada para complementar los niveles de dopamina en el cuerpo, produce efectos secundarios después de varios años de uso. Sorprendentemente, se demostró que el agua H2 tiene un efecto significativo sobre la enfermedad de Parkinson, al menos en los modelos de roedores de la enfermedad. Según estudios realizados en la Universidad de Nagoya, las ratas con neurodegeneración inducida por 6-hidroxidopamina (antagonista de la dopamina) en la sustancia negra lateral se comportan de manera anormal al girar en círculos cuando estimulados con metanfetamina, pero estos movimientos anormales no ocurrieron en absoluto cuando los animales recibieron agua H2 por adelantado. El efecto se mantuvo incluso cuando se administró agua H2 3 días después de la administración del fármaco[32]. En un experimento detallado con ratones realizado de forma independiente en la Universidad de Kyushu, la administración de agua H2 ayudó a suprimir los cambios inducidos por MPTP (1-metil-4-fenil-1,2,3,6-tetrahidropiridina) en las células y la función del cerebro que son normalmente asociado con la enfermedad de Parkinson[33].
Enfermedades pulmonares
Las causas y los síntomas de las lesiones/enfermedades pulmonares son muy variables, y algunas de las enfermedades pulmonares que exhiben una alta incidencia y mortalidad constituyen la principal causa de muerte en el mundo. Aquí describo algunos resultados de experimentos con animales que demostraron la eficacia del H2 molecular en estas enfermedades complejas. Se ocupo principalmente de lesiones/enfermedades pulmonares agudas, y agregó una descripción de una enfermedad pulmonar crónica EPOC. La lesión pulmonar aguda (ALI, por sus siglas en inglés) es un nombre colectivo dado a un grupo de enfermedades con síntomas similares que surgen de muchas causas diferentes. La lesión hiperóxica causada por respirar un gas con altas concentraciones de oxígeno es una de las ALI, que es una de las principales causas de morbilidad y mortalidad en pacientes críticos. Los efectos del H2 sobre las lesiones hiperóxicas fueron estudiados sobre el modelo de ratas. Criaron ratas en hiperoxia (>98 % O2) durante 60 h para probar el efecto de la inyección de solución salina disuelta en H2[34]. Durante este período, la apoptosis celular aumentó del 5 % en normoxia a ~30 % en hiperoxia, que se redujo a ~20 % mediante la inyección de solución salina H2. Muestran la variación de los marcadores de estrés oxidativo, MDA, actividad de SOD y 8-OHdG. Claramente, el estrés oxidativo aumenta en la hiperoxia, que se reduce mediante la inyección de solución salina con H2.
Se cree que el mecanismo de la lesión hiperóxica es tal que las ROS producidas por la exposición a la hiperoxia invocan a las células pulmonares para aumentar la secreción de citocinas para reclutar leucocitos en el pulmón, que a su vez producen ROS adicionales para formar un círculo vicioso[35]. La supresión de MPO indica que el H2 interrumpe efectivamente el círculo vicioso. El efecto preventivo del H2 sobre la lesión pulmonar puede ser consecuencia de la supresión de la respuesta inflamatoria excesiva y su cascada aguas abajo. Audi et al. demostraron que SPECT (tomografía computarizada por emisión de fotón único) se puede utilizar para obtener Imag2 de la distribución del estrés oxidativo en el pulmón[36], y aplicó la técnica para la observación in vivo de la muerte de células endoteliales en ALI inducida por hiperoxia en ratas. El compuesto Tc radiactivo 99mTc-HMPAO (óxido de hexametilpropilenamina) y 99mTcduramicina administrados a través del catéter en la vena femoral se acumulan en la superficie de las células muertas y sirven como marcador de muerte celular[37].
2.4.6 Efectos preventivos del hidrógeno molecular
Como se describe, la administración de H2 molecular antes de la irradiación mejoró las lesiones por radiación, y este efecto radioprotector se mantuvo durante largos períodos de tiempo, por ejemplo, durante 100 días. Esta es una clara indicación de que el H2 molecular ayudó a establecer un estado para hacer frente a la radiación, muy probablemente al activar el sistema antioxidante innato. La bioquímica de tal sistema antioxidante está bajo estudios intensivos. Los efectos preventivos del H2 molecular también se observaron en el caso de la enfermedad de Parkinson. Cuando se trató a ratones con enfermedad de Parkinson inducida por fármacos con agua H2 1 semana antes de la inducción de la enfermedad, los síntomas fueron menos graves que cuando se administró después del inicio de la enfermedad, y también hubo menos muerte de células neuronales en el cerebro[38] . Esto demuestra que la administración de agua H2 puede ser útil para prevenir la enfermedad de Parkinson. Además, mientras que la tasa de supervivencia de tres días de los ratones con sepsis inducida por fármacos es del 25 %, la tasa de supervivencia mejoró a aproximadamente el 60 % cuando los ratones recibieron continuamente agua H2. En particular, incluso cuando los ratones fueron tratados con agua H2 durante 3 días antes de la administración del fármaco, la tasa de supervivencia aumentó al 50 %, lo que demuestra que el agua H2 también puede prevenir la sepsis. Si bien todos estos estudios se refieren a ratones, si estos hallazgos se pueden traducir a humanos, sería una gran revelación. Beber agua H2 regularmente puede ayudar a prevenir la enfermedad de Parkinson, que no tiene un tratamiento efectivo, al tiempo que suprime la incidencia de sepsis que representa el 20-30% de las causas de muerte entre los pacientes que ingresan a la unidad de cuidados intensivos en los hospitales. Es probable que la capacidad del hidrógeno para prevenir enfermedades se convierta en un campo importante de la medicina del hidrógeno molecular en el futuro.
2.4.7 El origen de la fatiga y el envejecimiento
2.4.7.1 El mecanismo de la fatiga
Aunque la fatiga se produce después de trabajar demasiado o hacer demasiado ejercicio, eventualmente nos recuperamos de dicha fatiga. Esta es la respuesta normal del cuerpo. ¿Qué significa entonces estar “cansado”? De hecho, la causa de la fatiga solo se ha entendido correctamente recientemente. La escuela de pensamiento anterior proponía que la acumulación de ácido láctico con el ejercicio conduce a la fatiga. Esto está mal. Lo que realmente sucede es que el ejercicio conduce a la formación y acumulación de aniones superóxido, uno de los ROS, lo que produce fatiga. En el cuerpo, siempre se producen algunos aniones superóxido durante el metabolismo, pero se descomponen por la acción de la enzima superóxido dismutasa (SOD) y se vuelven inofensivos. Sin embargo, si este equilibrio se destruye debido a un ejercicio excesivo, el anión superóxido no se puede procesar por completo, lo que genera “fatiga”. Se han realizado numerosos experimentos sobre el efecto del hidrógeno para mitigar la fatiga. Los experimentos con animales con caballos de carrera y los estudios de medicina deportiva con atletas han demostrado que las ROS se generan durante el ejercicio y la fatiga muscular resultante se mitiga cuando se administra agua H2 (por vía oral o intravenosa) antes del ejercicio. En Japón, la investigación a gran escala sobre la fatiga comenzó en la década de 1990 y, en 2003, se organizó una colaboración entre la industria, el gobierno y la academia con centro en Osaka, denominada “Proyecto antifatiga”; desde entonces, la Universidad de la ciudad de Osaka ha servido como base para una creciente investigación. Los datos de esta colaboración han revelado que la fatiga se reconoce cuando los productos de desecho generados por ROS se acumulan en el cuerpo. Estos desechos crean una serie de proteínas llamadas factores de fatiga que luego actúan sobre el cerebro. La señal crea un factor de restauración de fatiga, reparando el daño celular causado por ROS. Los detalles de la sustancia activa aún se desconocen, pero se demostró que la corteza frontal orbital craneal es el sitio que detecta y trata la fatiga. Esta investigación ha continuado desde entonces y se publicó un informe detallado sobre el efecto antifatiga del agua H2[39] . Según este informe, beber agua H2 durante 4 semanas alivia la fatiga en forma de somnolencia, nerviosismo y disminución de la eficiencia en el trabajo, al tiempo que mejora la motivación y la relajación. También se ha observado una mejora en la función nerviosa autónoma y la función cognitiva (tiempo de respuesta). Por lo tanto, se ha demostrado que el agua H2 alivia la fatiga física y mental, lo que sugiere que es útil para la vida cotidiana. Los relatos anecdóticos populares como “Me cansé menos fácilmente después de comenzar a beber agua H2” y “mi cuerpo se sintió más liviano” no son meramente fenómenos psicológicos, ya que la capacidad del agua H2 para mitigar la fatiga y ayudar en la recuperación ha sido verificada científicamente. Por cierto, existen preocupaciones sobre posibles interrupciones en el mundo del deporte si se descubre que el efecto del hidrógeno sobre la fatiga muscular es significativo[40]. Los récords atléticos seguramente caerían uno tras otro si todos los atletas comenzaran a beber agua H2; sin embargo, dado que el hidrógeno ha sido aprobado como aditivo alimentario, el agua H2 no debe considerarse una sustancia prohibida. Además, el hidrógeno ingerido se descarga rápidamente sin dejar rastro. Por lo tanto, no hay forma de probarlo. El “efecto hidrógeno” en los registros deportivos y atléticos puede convertirse en un tema importante en el futuro.
2.4.8 La solubilidad del hidrógeno en agua
Cuando el agua se expone al hidrógeno gaseoso, se disuelve una pequeña cantidad de hidrógeno en el agua, al igual que el agua en contacto con el aire disuelve el oxígeno y permite que los peces sobrevivan respirando el oxígeno disuelto a través de sus branquias. La cantidad de gas disuelto (es decir, la solubilidad) es diferente para diferentes gases y depende de la temperatura. La solubilidad suele ser bastante limitada y es del orden de miligramos (mg) por litro de agua (1 kg), que es el equivalente a partes por millón (ppm) en peso. La figura 2.1 muestra la dependencia de la temperatura de la solubilidad del hidrógeno y el oxígeno en agua. A temperatura ambiente (20 ºC), la solubilidad del hidrógeno es de 1,6 ppm. Cuando se alcanza este límite, el agua se denomina agua hidrogenada saturada. A temperatura ambiente, la solubilidad del hidrógeno es aproximadamente 1/30 de la del oxígeno. Sin embargo, dado que la masa molecular del hidrógeno es 1/16 de la del oxígeno, el número de moléculas de hidrógeno que se disuelve a temperatura ambiente es casi la mitad del número de moléculas de oxígeno. Las solubilidades que se muestran en la Fig. 2.1 corresponden a 1 atm (0,1 MPa) de presión de gas. Como la solubilidad es proporcional a la presión, el agua en contacto con 1 atm de aire está sujeta a 0,02 MPa de presión de oxígeno (presión parcial), por lo que la solubilidad del oxígeno es el 20% de la que se presenta en la figura. El hidrógeno no existe en la atmósfera ordinaria, lo que significa que su presión parcial es cero y la solubilidad del hidrógeno en agua expuesta al aire es cero. Así, si el agua de hidrógeno preparado de alguna manera se deja en la atmósfera, las moléculas de hidrógeno escaparán gradualmente de la superficie y la concentración finalmente volverá a 0. La solubilidad del hidrógeno en solución salina fisiológica no es muy diferente del agua pura.
2.4.8.1 Enlaces de hidrógeno en el agua
Dado que el agua es una sustancia común, sus propiedades bien pueden aceptarse como comunes sin ninguna duda. De hecho, el agua es una sustancia con propiedades únicas, que son de particular importancia para la vida. La singularidad del agua es evidente en sus propiedades térmicas. Normalmente, cuando un sólido se convierte en líquido (fusión), se vuelve menos denso. Sin embargo, en el agua ocurre lo contrario; el hielo es menos denso que el agua líquida. Además, la densidad del agua líquida se vuelve máxima a cierta temperatura (4 ºC). Imagínese, si la densidad del hielo fuera mayor que la del agua líquida, el hielo formado en la superficie se hundiría hasta el fondo y eventualmente convertiría toda el agua en hielo. Entonces, los peces no podrían nadar bajo el hielo en invierno, y todos los organismos acuáticos habrían muerto congelados. El calor de fusión, la capacidad calorífica y el calor de evaporación del agua son mucho más altos que otras sustancias de estructura similar, y el punto de ebullición del agua es excepcionalmente alto dentro de la serie CH4, NH3 (amoníaco), H2O y HF (ácido fluorhídrico), y los compuestos de hidrógeno con los elementos vecinos en la tabla periódica C, N, O y F (flúor). El punto de ebullición es la temperatura a la cual las moléculas se liberan del estado líquido porque la energía térmica de un molécula vence la fuerza de atracción entre las moléculas que operan en el líquido. Cuanto más alto es el punto de ebullición, más fuerte es la atracción intermolecular en los líquidos. Esta atracción que opera entre las moléculas de agua proviene de la interacción intermolecular llamada enlace de hidrógeno. Por lo general, las moléculas se forman a partir de átomos mediante enlaces covalentes. En la molécula de agua H2O, dos enlaces covalentes entre el O y el H producen una molécula con forma casi de “V”, pero con un ángulo menos agudo (figura 2.2). Sin embargo, cuando se acerca otra molécula de agua, la fuerza de atracción actúa entre el O de la primera molécula y el H de la molécula adyacente. Esta es la interacción llamada enlace de hidrógeno. Los enlaces de hidrógeno son más débiles que los enlaces covalentes, aproximadamente 1/10 de los enlaces covalentes, pero dan lugar a varias propiedades que no se pueden pasar por alto. En la estructura cristalina del hielo, el átomo de O está rodeado por 4 átomos de H; con átomos de 2 H fuertemente unidos por enlaces covalentes intramoleculares, y los átomos de 2 H restantes débilmente unidos por enlaces de hidrógeno a moléculas de agua adyacentes. En el agua líquida, los enlaces de hidrógeno se forman y diseccionan constantemente con el movimiento molecular, pero en promedio, varias moléculas de agua tienden a agruparse por la acción de los enlaces de hidrógeno. Además, H y OH (H+, OH-) pueden migrar muy rápidamente en agua líquida a lo largo del camino formado por enlaces de hidrógeno. Los enlaces de hidrógeno tienen implicaciones muy importantes para la estructura y las reacciones de las biomoléculas en los cuerpos vivos. El agua también disuelve muchas sustancias. Además de gases como el hidrógeno, el oxígeno y el dióxido de carbono, las sustancias sólidas como el cloruro de sodio se disuelven como iones en el agua. Actualmente, el agua de mar contiene sodio, cloruro y muchos otros iones en solución. Esto se debe a que, en el proceso de circulación global del agua, las sustancias disueltas y transportadas por el caudal de los ríos se han ido acumulando y concentrando en el océano durante la larga historia de la Tierra. Ningún otro líquido puede disolver tantos tipos de sustancias. Esta gran capacidad de disolución es la clave del transporte de masa en los cuerpos vivos. Sin embargo, hay sustancias que no se mezclan con el agua. Un ejemplo típico es el petróleo. Algunos materiales son fácilmente solubles en agua pero poco solubles en aceite, mientras que otros materiales son difícilmente solubles en agua y fácilmente solubles en aceite. La primera se denomina sustancia hidrofílica, mientras que la segunda es lipofílica (hidrofóbica).
 17.22.48.png)
Fig. 2.1 Dependencia de la temperatura de la solubilidad del gas H2 y O2 en agua. Los valores se refieren a la solubilidad para la presión parcial de 1 atm (0,1 MPa) del gas en contacto con el agua. H2 en la escala izquierda y O2 en la escala derecha. Tenga en cuenta que la dependencia de la temperatura es pequeña en H2.
Esta diferencia proviene de la diferencia en la estructura molecular. Las sustancias que contienen un grupo hidroxilo (OH) en una molécula, como el azúcar, el alcohol etílico y el ácido acético, tienen una gran afinidad con el agua porque el oxígeno de estas moléculas forma enlaces de hidrógeno con el hidrógeno del agua circundante. Un grupo como OH que se une fácilmente al agua se llama grupo hidrofílico. Por el contrario, los aceites como el petróleo y los lípidos (grasas)/aceites animales/vegetales no contienen grupos hidrofílicos como OH; por lo tanto, son insolubles en agua. En cambio, las secciones de cadena larga que consisten en C y H tienden a unirse entre sí; por lo tanto, los aceites se disuelven fácilmente entre sí. Tales secciones estructurales se denominan grupos lipofílicos. Algunas moléculas más grandes tienen grupos hidrofílicos y lipofílicos. Por ejemplo, en el ácido oleico, unido al final de la cadena C-H (C17H33) hay un grupo carboxilo (COOH), que funciona como un grupo hidrofílico, mientras que la estructura principal, C17H33, actúa como un grupo lipofílico. Cuando una molécula posee componentes hidrofílicos y lipofílicos, se dice que es anfifílica. Esquemáticamente, se expresa en forma de renacuajo, con una cabeza que representa el grupo hidrofílico unida a una cola que representa el grupo lipofílico. Las membranas celulares in vivo están hechas de moléculas anfifílicas, de las cuales los fosfolípidos son especialmente importantes. En la figura 2.3 se muestra una estructura de membrana. Consta de dos capas; ambos lados de la membrana (tanto el exterior como el interior de la célula) son hidrófilos, pero la presencia de una capa lipófila en el medio hace que la membrana sea impermeable al agua. De esta manera, una membrana celular produce un espacio cerrado que separa la célula del ambiente externo. Sin embargo, para sustentar las actividades vitales, las células deben poder intercambiar sustancias con el entorno externo. Para este fin, existen muchos tipos de canales (pasajes) diseñados para el paso de moléculas específicas.
 17.31.04.png)
Fig. 2.3 Estructura de doble capa de la membrana celular. La membrana celular consiste en capas dobles de polímeros anfipáticos, el exterior de los cuales es hidrófilo y el interior litófilo. ? segmento hidrofílico, ~ segmento litófilo.
2.4.8.2 Mecanismo de túnel en la migración atómica/molecular
Las moléculas de hidrógeno son extremadamente móviles en los tejidos biológicos, al igual que los átomos de hidrógeno en el agua. Este rápido movimiento atómico se debe al mecanismo llamado tunelización, que solo podría realizarse con átomos y moléculas de hidrógeno livianos. Los túneles solo se pueden describir en términos de física cuántica, las leyes de la física que gobiernan el mundo de la escala microscópica. Aunque su explicación en lenguaje común no es fácil, trato de hacerlo porque varias propiedades únicas del hidrógeno en los organismos no pueden discutirse sin este concepto.
2.4.8.3 ¿Qué es el mecanismo de tunelización?
El hecho de que un átomo resida en una determinada ubicación en una sustancia significa que la ubicación proporciona un entorno estable para el átomo, en otras palabras, un entorno de estado de baja energía para el átomo residente. Sin embargo, cuando un átomo se mueve en una sustancia, el átomo se mueve de un lugar estable a otro lugar vecino, sucesivamente, y migra una gran distancia en el tiempo por repeticiones. Pero, para que el átomo se mueva de una posición estable (el mínimo de energía) a otra, debe atravesar el paso (barrera de energía) que se encuentra en el medio. Como el salto atómico suele ocurrir con la ayuda de la energía térmica suministrada por el medio ambiente, se denomina proceso de activación térmica, proceso más común a temperaturas más altas. La situación es similar a la de reubicar agua acumulada en una cuenca a una cuenca vecina; se necesita energía de alguna fuente externa para transportar el agua por el paso. Sin embargo, si las dos cuencas están conectadas por una línea de agua subterránea o un túnel, entonces el agua fluirá lentamente por sí misma sin necesidad de energía adicional. Un fenómeno similar ocurre a escala atómica, el proceso de tunelización, como se esquematiza en la figura 2.4. Debido a que el proceso de formación de túneles no requiere energía térmica, la velocidad de migración atómica es independiente de la temperatura y, por lo tanto, la migración puede ocurrir incluso a bajas temperaturas. De acuerdo con la física cuántica, las condiciones para que ocurra el túnel son las siguientes:
1. La masa de la partícula en movimiento debe ser pequeña.
2. La barrera de energía intermedia debe ser baja y de pequeño espesor.
 17.35.51.png)
Fig. 2.4 Migración de átomos por tunelización. El átomo cambia de posición del estado inicial al estado final sin traspasar la barrera energética.
Debido al primer requisito, la tunelización suele ser observable para los electrones, pero en la década de 1990, la tunelización también se confirmó en los átomos de hidrógeno, el átomo con la masa más pequeña (1800 veces la de los electrones). Dado que el hidrógeno está involucrado en casi todas las reacciones bioquímicas del cuerpo humano, es de esperar y verificar que la tunelización desempeñe un papel importante allí.
2.4.8.4 Movimiento de túnel de los átomos de hidrógeno
Las moléculas de agua se mueven constantemente en el agua, pero si se toma una instantánea en cualquier instante, se verá que las moléculas de agua están débilmente unidas entre sí y la migración de un átomo de hidrógeno ocurre entre las moléculas de agua vecinas conectadas por un enlace de hidrógeno. La figura 2.5 explica el proceso: cuando un átomo de hidrógeno se mueve de izquierda a derecha entre átomos de oxígeno (OA y OB) pertenecientes a moléculas de agua vecinas, la energía del átomo de hidrógeno cambia como (a)!(b)!(c). Observe que un movimiento de OA a OB se logra mediante un pequeño cambio en la posición del átomo de hidrógeno a distancia promedio entre los átomos de oxígeno conectados por puentes de hidrógeno es de 2.8 angstroms (Å, 100 millonésimas de cm), pero si la distancia se acorta ligeramente por el movimiento molecular, surge un estado intermedio con dos mínimos de energía, como se muestra en la figura 2.5 (b). Entonces, la barrera de energía entre los dos mínimos se vuelve baja y estrecha, lo que satisface la condición para el efecto túnel del átomo de hidrógeno. Por lo tanto, la rápida migración de los átomos de hidrógeno en el agua se debe al proceso cooperativo de formación de túneles y enlaces de hidrógeno. Otro ejemplo de tunelización de átomos de hidrógeno es el movimiento de los átomos de H y D en el 2-acetilpirrol, que es una molécula orgánica utilizada en los perfumes. La frecuencia de los saltos H y D entre dos sitios vecinos (posiciones) en anillos pentagonales de 5 miembros de carbono y nitrógeno depende de la temperatura[41], como se muestra en la Fig. 2.6. Como se puede ver de inmediato, la diferencia entre los átomos de H y D es muy grande. Si el salto atómico fue causado por activación térmica, se espera que la frecuencia de salto de H sea solo un poco mayor que D (casi 1.4 veces), mientras que los experimentos mostraron que la frecuencia de salto de H es casi diez veces mayor a 20º C. A bajas temperaturas, ambas frecuencias de salto parecen acercarse a valores constantes. Estas son exactamente las características esperadas para el movimiento de túnel. En este caso, la distancia entre los sitios vecinos es corta y la barrera energética es baja; por lo tanto, se espera que se satisfagan las condiciones para la construcción de túneles. Debido a que la transferencia de átomos de hidrógeno es fundamental para muchas reacciones bioquímicas, el movimiento de túnel constituye un proceso de física cuántica extremadamente importante.
 17.39.28.png)
Fig. 2.5 Túnel de un átomo de H a través de un enlace de hidrógeno entre moléculas de agua vecinas. Cuando dos átomos de O se acercan, se forman dos mínimos de energía en el medio, y el átomo de H puede cambiar su posición haciendo un túnel. Para más detalles, consulte enlace covalente, enlace de hidrógeno.
 17.44.33.png)
Fig. 2.6 Ejemplos de saltos atómicos por tunelización. Dependencia de la temperatura de las frecuencias de salto de los átomos de H y D en la molécula orgánica acetilpirrol. La frecuencia de salto de un átomo de H es mucho mayor que la de un átomo de D y tiende a estabilizarse a bajas temperaturas. Estas son las características características del movimiento de túnel.
2.4.8.5 Movimiento de efecto túnel de las moléculas de hidrógeno
Como ya se describe el hidrógeno molecular se mueve rápidamente en el cuerpo, atraviesa las membranas celulares y llega fácilmente a los orgánulos de la célula. Para estas características peculiares, los siguientes tres factores son responsables:
1. Debido a que las moléculas de hidrógeno son de tamaño pequeño, pueden pasar fácilmente a través de espacios estrechos entre las biomoléculas.
2. Debido a que las moléculas de hidrógeno son químicamente muy estables, rara vez reaccionan con alguna sustancia del cuerpo.
3. La pequeña masa de moléculas de hidrógeno facilita la formación de túneles.
Las formas del átomo de H y la molécula de H2 se muestran en la figura 2.7. Cuando la molécula se escribe como H–H, uno podría pensar que parece una mancuerna; en realidad, es casi esférico con dos electrones orbitando alrededor de dos núcleos (protones) separados por una corta distancia de 0.74 Å. Su forma es similar a un átomo de hidrógeno con un electrón orbitando alrededor de un solo protón. Debido a que el tamaño de los átomos y las moléculas está determinado por la dispersión de los electrones, las moléculas y los átomos de hidrógeno tienen un tamaño similar. Sin embargo, a diferencia de los átomos de hidrógeno, las moléculas de hidrógeno son tan estables que no interactúan con las sustancias circundantes, en particular, no forman enlaces de hidrógeno. Estas propiedades favorecen el paso de las moléculas de hidrógeno a través de los biopolímeros. Por el contrario, el movimiento de iones como H3O+ y OH en biomateriales es muy limitado. Esto se debe a que sus tamaños determinados por el oxígeno con nueve electrones son demasiado grandes para escabullirse a través de la red de biomateriales, y también porque su masa es demasiado grande para permitir que ocurra la formación de túneles.
 17.47.31.png)
Fig. 2.7 Distribución de electrones alrededor de un átomo de H y una molécula de H2. La distribución alrededor de una molécula de H2 no tiene forma de pesa, sino casi esférica, muy similar a un átomo de H.
La posibilidad de túneles de moléculas de hidrógeno es, de hecho, bastante delicada. Debido a que la masa de la molécula de H2 es el doble de la de un átomo de H, la misma que la de un átomo de D, puede parecer menos probable que ocurra la tunelización de las moléculas de H2. Sin embargo, las pequeñas interacciones de las moléculas de H2 con las sustancias circundantes deberían hacer que la barrera de energía para el movimiento sea más baja que en el caso de los átomos de H. Por lo tanto, bien puede esperarse un movimiento de túnel de las moléculas de hidrógeno. Casi no ha habido informes en la literatura sobre la migración de moléculas de hidrógeno en materiales biológicos. Las moléculas de hidrógeno son transportadas de manera efectiva por el flujo sanguíneo, pero para que sean fisiológicamente efectivas, deben ir dentro de los materiales biológicos. Quizás, el único informe relevante es la medición del tiempo medio de paso del hidrógeno molecular a través del cuerpo vítreo del ojo de las ratas después de la administración de agua hidrogenada:
 17.52.12.png)
La inhalación de gas H2 por parte de ratas aumentó la concentración de H2 en la sangre. La concentración de H2 se midió después de 1 h de inhalación de gas mezclado con H2. La concentración aumentó en proporción a la concentración de H2 en el gas, menor en la vena que en la arteria.
En este experimento, las moléculas de H2 tardaron 5 minutos en penetrar aproximadamente 5 mm del cuerpo vítreo, lo que indica que la movilidad en este material biológico era similar a la de macromoléculas como el caucho natural y el polietileno. Este valor también es comparable a la movilidad de los átomos de hidrógeno en el agua, típica de la migración atómica por efecto túnel. Por lo tanto, es muy probable que las moléculas de hidrógeno penetraran en el cuerpo vítreo a través de un túnel. La molécula de deuterio (D2) tiene casi la misma forma que el H2, pero su masa es el doble que la del H2 y cuatro veces la de los átomos de H. Por lo tanto, se espera que la formación de túneles de las moléculas D2 sea bastante limitada. Por lo tanto, no se espera que el gas D2 y el agua pesada (D2O) tengan beneficios para la salud similares a los del agua hidrogenada.
2.4.8.6 El mecanismo de Grotthuss para la migración del hidrógeno en el agua
Se sabe que el hidrógeno en el agua es muy móvil, y cada vez que surge este tema, uno no puede dejar de mencionar el nombre de Grotthuss. ¿Es comprensible este fenómeno en términos del mecanismo de Grotthus? ¿Es el mecanismo de Grotthuss realmente correcto? Estas son las preguntas que se hacen con frecuencia y se repiten, incluso ahora. Pero por lo que pude deducir, parecía que el contexto en el que se hacía referencia al artículo de Grotthuss no siempre era el mismo. ¿Qué es exactamente el mecanismo de Grotthuss? ¿Qué estaba realmente escrito en el artículo de Grotthuss? Sentí mucha curiosidad, ¡y más aún cuando me di cuenta de que su artículo fue escrito en 1806! En ese momento, aunque se sabía que el agua constaba de hidrógeno y oxígeno, se desconocía cómo se formaba a partir de átomos de H y O, y aún no se había establecido el concepto de molécula. Treinta años después del artículo de Grotthuss, Michael Faraday propuso el concepto de iones, es decir, que en el agua los átomos se convierten en partículas cargadas (llamadas iones). Estando muy ansioso por leer el periódico, me esforcé por obtener una copia, todo fue en vano. Me enteré de que no había una sola copia disponible en Japón. Me acordé de un comentario: “El artículo de Grotthuss se cita con más frecuencia de lo que se lee. . .” Entonces, decidí pedirle a mi amigo de la École Polytechnique en Francia que me enviara una copia, y finalmente obtuve en mi mano, gracias a su amable ayuda. Leamos el artículo de Grotthuss sin ninguna idea preconcebida.
En sus experimentos, Grotthuss utilizó la pila voltaica de Alessandro Volta, la primera batería eléctrica del mundo; indicó que la electricidad obtenida de este dispositivo era electricidad galvánica, a diferencia de la triboelectricidad. Con el invento de Volta (1799), se pudo obtener continuamente una gran corriente (cantidad de electricidad) y la investigación sobre los fenómenos eléctricos avanzó rápidamente. En 1800, William Nicholson y Anthony Carlisle electrolizaron con éxito agua en oxígeno e hidrógeno. Sin embargo, se desconocía el mecanismo por el cual la pila voltaica de Volta producía electricidad positiva y negativa, y era el problema científico más desafiante en ese momento. Grotthuss entró en el campo de la investigación en esa etapa. El artículo de Grotthuss constaba de dos partes. La Parte 1 describe la electrólisis de una solución acuosa de sal metálica, es decir, la reacción que ocurre cuando se colocan dos electrodos de oro en una solución acuosa y se conectan a una batería Volta. Por ejemplo, cuando los electrodos se sumergieron en una solución acuosa de acetato de plomo, el plomo metálico creció de forma dendrítica desde el electrodo negativo y se extendió hacia el electrodo positivo, siguiendo la dirección del flujo de corriente. Grotthuss escribió que parecían plantas creciendo en busca de la luz del sol. Treinta años más tarde, Faraday reconoció que el concepto de líneas eléctricas de fuerza propuesto por él se inspiró de hecho en esta observación de Grotthuss. La Parte 2 del documento considera el mecanismo de electrólisis del agua. Grotthuss indicó que la pila voltaica de Volta era un par de electrodos positivos y negativos de cobre y zinc que formaban un imán eléctrico o similar; así, se le ocurrió que las partículas que constituyen el agua también deben estar compuestas por pares de electricidad positiva y negativa. Explicó además el mecanismo por el cual se generaron oxígeno e hidrógeno a partir de los electrodos positivo y negativo, respectivamente.
Se colocó agua en un tubo de vidrio en forma de U con un alambre de oro en cada uno de los lados derecho e izquierdo del tubo conectado a los electrodos positivo  y negativo
y negativo  , respectivamente, de una batería Volta. Las moléculas de agua estaban representadas por conjuntos de oxígeno (O) con carga negativa
, respectivamente, de una batería Volta. Las moléculas de agua estaban representadas por conjuntos de oxígeno (O) con carga negativa e hidrógeno (H) con carga positiva
 ; y L se dibujaron y alinearon con los lados de los electrodos positivo y negativo, respectivamente. La electrólisis del agua fue causada por el oxígeno (o) de la molécula de agua más a la derecha que se perdió en el electrodo positivo. El hidrógeno restante (h) formó una molécula de agua con su vecino oxígeno (escrito como r) a la izquierda; por lo tanto, el hidrógeno restante se unió al oxígeno para crear moléculas de agua más a la izquierda. A medida que las moléculas se movían hacia la izquierda de esta manera, en el extremo izquierdo, el hidrógeno restante se transportaba al electrodo negativo y se liberaba. Por lo tanto, la electrólisis del agua ocurrió solo en ambos extremos del "cable" de agua. En medio de este hilo de agua, el hidrógeno (u oxígeno) se movía secuencialmente hacia sus vecinos, de modo que las moléculas de agua aquí no estaban sujetas a la acción de la electrólisis. En solución, esta acción de electrólisis se realizaba a lo largo de un camino sobre el que actuaba la fuerza eléctrica, es decir, se realizaba a lo largo de una línea de fuerza eléctrica. A medida que se llevó a cabo la electrólisis, se generaron oxígeno e hidrógeno en el electrodo positivo y negativo, respectivamente, mientras que el agua en el medio de la línea de fuerza eléctrica no cambió de su estado original. Este razonamiento explicó claramente los resultados experimentales de la electrólisis.
; y L se dibujaron y alinearon con los lados de los electrodos positivo y negativo, respectivamente. La electrólisis del agua fue causada por el oxígeno (o) de la molécula de agua más a la derecha que se perdió en el electrodo positivo. El hidrógeno restante (h) formó una molécula de agua con su vecino oxígeno (escrito como r) a la izquierda; por lo tanto, el hidrógeno restante se unió al oxígeno para crear moléculas de agua más a la izquierda. A medida que las moléculas se movían hacia la izquierda de esta manera, en el extremo izquierdo, el hidrógeno restante se transportaba al electrodo negativo y se liberaba. Por lo tanto, la electrólisis del agua ocurrió solo en ambos extremos del "cable" de agua. En medio de este hilo de agua, el hidrógeno (u oxígeno) se movía secuencialmente hacia sus vecinos, de modo que las moléculas de agua aquí no estaban sujetas a la acción de la electrólisis. En solución, esta acción de electrólisis se realizaba a lo largo de un camino sobre el que actuaba la fuerza eléctrica, es decir, se realizaba a lo largo de una línea de fuerza eléctrica. A medida que se llevó a cabo la electrólisis, se generaron oxígeno e hidrógeno en el electrodo positivo y negativo, respectivamente, mientras que el agua en el medio de la línea de fuerza eléctrica no cambió de su estado original. Este razonamiento explicó claramente los resultados experimentales de la electrólisis.
La idea de que las moléculas de agua contienen partículas constituyentes con cargas positivas y negativas fue la precursora de la idea de que las partículas cargadas existen a nivel molecular (atómico), pero desafortunadamente, la idea estaba demasiado adelantada a su tiempo para ser ampliamente aceptada. No fue hasta 30 años después que Faraday estableció el concepto y llamó a las partículas constituyentes "iones". Además, dado que la noción de que las partículas constituyentes moleculares con cargas positivas y negativas se disocian y se mueven debido a la fuerza eléctrica estaba demasiado alejada de la visión predominante de las sustancias en ese momento, pasaron 100 años antes de que la idea fuera completamente evaluada. Por lo tanto, el nombre de Grotthuss no es muy conocido, pero creo que su contribución a la ciencia debería reevaluarse. Daneel (1905) revivió el manuscrito de Grotthuss 100 años después. En ese momento, se había medido la movilidad de varios iones en solución acuosa; entre ellos, se observó que la movilidad de los iones de hidrógeno [en realidad, iones de hidronio (H3O+) unidos a moléculas de agua] e iones de hidróxido (OH) era excepcionalmente grande, y esto se consideró un enigma. En ese momento, generalmente se aceptaba que los iones eran impulsados ??por la fuerza eléctrica mientras encontraban una resistencia viscosa de su entorno y, por lo tanto, la movilidad de los iones debería estar determinada principalmente por el tamaño del ion. Sin embargo, los iones H3O+ y OH- se mueven aproximadamente siete y tres veces más rápido, respectivamente, que el ion potasio (K+), que tiene aproximadamente el mismo tamaño. Danneel pensó que en el agua no se transportaba todo el ion sino sólo el hidrógeno, como proponía Grotthuss. Debe admitirse que la teoría de Grotthuss está incompleta en su forma original. Para que L y las partículas continúen fluyendo en un modelo de alambre, las moléculas de agua en el camino deben rotar y las direcciones positiva y negativa deben invertirse cada vez. Esto significa que, en el proceso de migración a través de enlaces de hidrógeno que unen las moléculas de agua, deben tener lugar los reordenamientos apropiados de las moléculas de agua circundantes. De esta manera, con algunas modificaciones y refinamientos hechos en los años siguientes, el núcleo del mecanismo de Grotthuss, a saber, que los iones H+ se transportan sucesivamente entre moléculas de agua vecinas, ha sido entregado al presente (Cukierman 2006). Theodor von Grotthuss nació en 1785 en una familia de aristócratas alemanes que se trasladaron a la actual Lituania. Más tarde se convirtió en discípulo del químico francés Joseph Louis Gay-Lussac en París. Su artículo de 1806 se basó en sus experimentos realizados en Nápoles y Roma, que visitó con Gay-Lussac en 1805-1806 para investigar la erupción volcánica del Monte Vesubio. Grotthuss tenía 20 años cuando escribió este manuscrito. Al año siguiente, Grotthuss regresó a casa debido a problemas de salud, pero continuó sus experimentos por sí mismo en su propio laboratorio. Sin embargo, en 2 años, Grotthuss perdió la esperanza de su futuro y se quitó la vida en 1822. Fue una vida corta. Durante su vida, publicó solo unos pocos artículos, esencialmente solo un artículo reproducido aquí. Sin embargo, la publicación como esta es muy rara; ¡no ha perdido su frescura incluso después de 200 años! Para obtener más información sobre Grotthuss, el sitio web del famoso Hotel Grotthuss ubicado en su lugar de nacimiento, Vilnius, Lituania, tiene información sobre el químico.
[1] https://en.wikipedia.org/wiki/Recombination_(cosmology)
[2] US Department of Energy. https://www.eere.energy.gov/hydrogenandfuelcells
[3] https://en.wikipedia.org/wiki/H_II_region
[4] https://en.wikipedia.org/wiki/Isotopes_of_hydrogen
[5] Russell, Grace & Kisher, Hesham & Nenov, Alexander & Hancock, John. (2021). Molecular Hydrogen as Medicine: An Assessment of Administration Methods. 10.3390/hydrogen2040025.
[6] Ding, He & Chang, Jinhu & He, Fei & Gai, Shili & Yang, Piaoping. (2021). Hydrogen Sulfide: An Emerging Precision Strategy for Gas Therapy. Advanced Healthcare Materials. 11.
DOI:10.1002/adhm.202101984.
[7] Ge, Li & Yang, Ming & Yang, Na-Na & Yin, Xin-Xin & Song, Wen-Gang. (2015). Molecular hydrogen: A preventive and therapeutic medical gas for various diseases. Oncotarget. 8.
DOI:10.18632/oncotarget.21130
[8] Hirano, Shin-Ichi & Yamamoto, Haru & Ichikawa, Yusuke & Sato, Bunpei & Takefuji, Yoshiyasu & Satoh, Fumitake. (2021). Molecular Hydrogen as a Novel Antitumor Agent: Possible Mechanisms Underlying Gene Expression. International Journal of Molecular Sciences. 22. 8724.
DOI:10.3390/ijms22168724.
[9] Zhang, Yan & Zhang, Jin & Fu, Zhiling. (2022). Molecular hydrogen is a potential protective agent in the management of acute lung injury. Molecular Medicine. 28.
DOI:10.1186/s10020-022-00455-y.
[10] Wang, Ruiying & Wang, Min & Zhou, Jiahui & Ye, Tianyuan & Xie, Xueheng & Ni, Dong & Ye, Jingxue & Han, Qiaoling & Di, Caixia & Guo, Liang & Sun, Gui-Bo & Sun, Xiaobo. (2019). Shuxuening injection protects against myocardial ischemia-reperfusion injury through reducing oxidative stress, inflammation and thrombosis. Annals of Translational Medicine. 7. 562-562.
DOI:10.21037/atm.2019.09.40.
[11] Nie, Chaoqun & Ding, Xue & Rong, A. & Li, Zhenning & Pan, Shuang & Yang, Wei. (2021). Hydrogen gas inhalation alleviates myocardial ischemia-reperfusion injury by the inhibition of oxidative stress and NLRP3-mediated pyroptosis in rats. Life Sciences. 272. 119248. DOI:10.1016/j.lfs.2021.119248.
[12] Hayashida, Kei & Miyara, Santiago & Shinozaki, Koichiro & Takegawa, Ryosuke & Yin, Tai & Rolston, Daniel & Choudhary, Rishabh & Guevara, Sara & Molmenti, Ernesto & Becker, Lance. (2021). Inhaled Gases as Therapies for Post-Cardiac Arrest Syndrome: A Narrative Review of Recent Developments. Frontiers in Medicine. 7. 586229.
DOI:10.3389/fmed.2020.586229.
[13] Zheng, Panpan & Kang, Jiyu & Xing, Entong & Zheng, Bin & Wang, Xueyao & Zhou, Huacheng. (2021). Lung Inflation With Hydrogen During the Cold Ischemia Phase Alleviates Lung Ischemia-Reperfusion Injury by Inhibiting Pyroptosis in Rats. Frontiers in Physiology. 12. 699344. DOI:10.3389/fphys.2021.699344.
[14] Nogueira, Jonatas & Passaglia, Patricia & Mota, Clarissa & Maitan Santos, Bruna & Batalhão, Marcelo & Carnio, Evelin & Branco, Luiz. (2018). Molecular hydrogen reduces acute exercise-induced inflammatory and oxidative stress status. Free Radical Biology and Medicine. 129.
DOI:10.1016/j.freeradbiomed.2018.09.028.
[15] Noda, Kentaro & Tanaka, Y. & Kawamura, Tomohiro & Billiar, T.R. & Kotani, Joji & Nakao, A.. (2014). A New Hydrogen Administration Method for Organ and Cardiac Graft Preservation. Journal of Surgical Research. 186. 654. 10.
DOI:1016/j.jss.2013.11.696.
[16] Kawamura, Tomohiro & Wakabayashi, Nobunao & Shigemura, Norihisa & Huang, Chien-Sheng & Masutani, Kosuke & Tanaka, Yugo & Noda, Kentaro & Peng, Ximei & Takahashi, Toru & Billiar, Timothy & Okumura, Meinoshin & Toyoda, Yoshiya & Kensler, Thomas & Nakao, Atsunori. (2013). Hydrogen gas reduces hyperoxic lung injury via the Nrf2 pathway. American journal of physiology. Lung cellular and molecular physiology. 304.
DOI:10.1152/ajplung.00164.2012.
[17] Yao, Li & Chen, Hongguang & Wu, Qinghua & Xie, Keliang. (2019). Hydrogen-rich saline alleviates inflammation and apoptosis in myocardial I/Rinjury via PINK-mediated autophagy. International Journal of Molecular Medicine. 44. 10.3892/ijmm.2019.4264.
[18] Yang, Fuxun & Lei, Yu & Liu, Rongan & Luo, Xiaoxiu & Li, Jiajia & Zeng, Fan & Lu, Sen & Huang, Xiaobo & Lan, Yunping. (2021). Hydrogen: Potential Applications in Solid Organ Transplantation. Oxidative Medicine and Cellular Longevity. 2021. 1-6. DOI:10.1155/2021/6659310.
[19] Oharazawa, Hideaki & Igarashi, Tsutomu & Yokota, Takashi & Fujii, Hiroaki & Suzuki, Hisaharu & Machide, Mitsuru & Takahashi, Hiroshi & Ohta, Shigeo & Ohsawa, Ikuroh. (2009). Protection of the Retina by Rapid Diffusion of Hydrogen: Administration of Hydrogen-Loaded Eye Drops in Retinal Ischemia-Reperfusion Injury. Investigative ophthalmology & visual science. 51. 487-92.
DOI:10.1167/iovs.09-4089
[20] Li, Yujie & Shen, Chengcheng & Zhou, Xin & Zhang, Jianghe & Lai, Xiaoyue & Zhang, Yi-ming. (2022). Local Treatment of Hydrogen-Rich Saline Promotes Wound Healing In Vivo by Inhibiting Oxidative Stress via Nrf-2/HO-1 Pathway. Oxidative Medicine and Cellular Longevity. 2022. 1-13.
DOI:10.1155/2022/2949824.
[21] Saitoh, Yasukazu & Yamaguchi, Yuuki & Okada, Yuhei. (2021). Protective effects of dissolved molecular hydrogen against hydrogen peroxide-, hydroperoxide-, and glyoxal-induced injuries to human skin keratinocytes. Molecular and Cellular Biochemistry. 476. DOI:10.1007/s11010-021-04189-z.
[22] Qiu, Peng & Liu, Yang & Zhang, Jin. (2019). Recent Advances in Studies of Molecular Hydrogen against Sepsis. International Journal of Biological Sciences. 15. 1261-1275. DOI:10.7150/ijbs.30741.
[23] Tamaki, Naofumi & Orihuela Campos, Rita & Inagaki, Yuji & Fukui, Makoto & Nagata, Tetsuji & Ito, Hiro-O. (2014). Resveratrol improves oxidative stress and prevents the progression of periodontitis via the activation of the Sirt1/AMPK and the Nrf2/antioxidant defense pathways in a rat periodontitis model. Free radical biology & medicine. 75. 222-229. DOI:10.1016/j.freeradbiomed.2014.07.034.
[24] Tamaki, Naofumi. (2015). Relationship among salivary antioxidant activity, cytokines, and periodontitis: the Nagasaki Island study.. Journal Of Clinical Periodontology. 42. 711-718.
[25] Hirano, Shin-Ichi & Ichikawa, Yusuke & Sato, Bunpei & Yamamoto, Haru & Takefuji, Yoshiyasu & Satoh, Fumitake. (2021). Molecular Sciences Molecular Hydrogen as a Potential Clinically Applicable Radioprotective Agent. International Journal of Molecular Sciences. 22.
DOI:10.3390/ijms22094566.
[26] Zheng, Mengna & Han, Yu & Xue, Yong & Yang, Tong & Tu, Qiufen & Xiong, Kaiqing & Deng, Daihua & Lu, Lei & Huang, Nan. (2021). The protective effect of hydrogen-rich water on rats with type 2 diabetes mellitus. Molecular and Cellular Biochemistry. 476.
DOI:10.1007/s11010-021-04145-x.
[27] Zhang, Yaxing & Xu, Jingting & Yang, Hongzhi. (2020). Hydrogen: An Endogenous Regulator of Liver Homeostasis. Frontiers in Pharmacology. 11. 877.
DOI:10.3389/fphar.2020.00877.
[28] Iketani, Masumi & Sekimoto, Kanako & Igarashi, Tsutomu & Takahashi, Mayumi & Komatsu, Masaki & Sakane, Iwao & Takahashi, Hiroshi & Kawaguchi, Hideo & Ohtani-Kaneko, Ritsuko & Ohsawa, Ikuroh. (2018). Administration of hydrogen-rich water prevents vascular aging of the aorta in LDL receptor-deficient mice. Scientific Reports. 8.
DOI:10.1038/s41598-018-35239-0.
[29] Lee, Hyunjin & Nagata, Kazufumi & Nakajima, Sanae & Ohno, Makoto & Ohta, Shigeo & Mikami, Toshio. (2018). Intermittent intense exercise protects against cognitive decline in a similar manner to moderate exercise in chronically stressed mice. Behavioural brain research. 345.
DOI:10.1016/j.bbr.2018.01.017.
[30] Liu, Fang-ting & Xu, Sheng-ming & Xiang, Zhenghua & Li, Xiang-nan & Li, Jian & Yuan, Hongbin. (2014). Molecular Hydrogen Suppresses Reactive Astrogliosis Related to Oxidative Injury during Spinal Cord Injury in Rats. CNS Neuroscience & Therapeutics. 20.
DOI:10.1111/cns.12258.
[31] Tsujimoto, Yoshihiro & Kuratsune, Daisuke & Kabayama, Shigeru & Miyazaki, Mariko & Watanabe, Yasuyoshi & Nishizawa, Yoshiki & Nakayama, Masaaki. (2021). Amelioration of fatigue in chronic dialysis patients with dialysis solution employing electrolyzed water containing molecular hydrogen (H2) and its association with autonomic function balance. Renal Replacement Therapy. 7. DOI:10.1186/s41100-021-00376-2.
[32] Zhang, Jian-ying & Chen, Long & Zhang, Lei & He, Zhu-qing & Huan, Peng-fei & Yang, Yu-fang & He, Jian-cheng. (2021). Compound Dihuang Granule Protects against 6-OHDA Induced Toxicity in Parkinson’s Disease Rats by Suppressing the Phosphorylation of MAPK/ERK1/2.
DOI:10.21203/rs.3.rs-847269/v1.
[33] Zhang, Haoming & Chen, Yijia & Wang, Zifan & Xie, Gaijie & Liu, Mingming & Yuan, Boyu & Chai, Hongxia & Cheng, Ping. (2022). Implications of Gut Microbiota in Neurodegenerative Diseases. Frontiers in Immunology. 13. DOI:10.3389/fimmu.2022.785644
[34] Dixon, Brandon & Zhang, John. (2016). An innovative collection in hydrogen molecular biology and medicine research. Medical Gas Research. 6. 55. DOI:10.4103/2045-9912.179347.
[35] Bhandari, Vineet & Choo-Wing, Rayman & Homer, Robert & Elias, Jack. (2007). Increased Hyperoxia-Induced Mortality and Acute Lung Injury in IL-13 Null Mice. Journal of immunology (Baltimore, Md. : 1950). 178. 4993-5000.
DOI:10.4049/jimmunol.178.8.4993.
[36] Sadri, Shima & Tomar, Dr. Namrata & Zhang, Xiao & Yang, Chun & Audi, Said & Cowley, Allen & Dash, Ranjan. (2022). Comparison of ROS production by forward and reverse electron transfer mechanisms in the heart and kidney cortex and outer medulla. Biophysical Journal. 121. 510a.
DOI:10.1016/j.bpj.2021.11.233.
[37] Sadri, Shima & Tomar, Dr. Namrata & Yang, Chun & Audi, Said & Cowley, Allen & Dash, Ranjan. (2020). Mechanistic computational modeling of the kinetics and regulation of NADPH oxidase 2 assembly and activation facilitating superoxide production. Free Radical Research. 54. 1-27. DOI:10.1080/10715762.2020.1836368.
[38] Chmielarz, Piotr & Saarma, Mart. (2020). Neurotrophic factors for disease-modifying treatments of Parkinson's disease: gaps between basic science and clinical studies. Pharmacological Reports. 72. DOI:10.1007/s43440-020-00120-3.
[39] Watanabe, Kyosuke & Sasaki, Akihiro & Tajima, Kanako & Mizuseki, Kenji & Mizuno, Kei & Watanabe, Yasuyoshi. (2019). Mental fatigue is linked with attentional bias for sad stimuli. Scientific Reports. 9. 8797.
DOI:10.1038/s41598-019-45428-0.
[40] Mizuno, Kei & Ojiro, Daichi & Tanaka, Takeshi & Minusa, Shunsuke & Kuriyama, Hiroyuki & Yamano, Emi & Kuratsune, Hirohiko & Watanabe, Yasuyoshi. (2020). Relationship between truck driver fatigue and rear-end collision risk. PloS one. 15. e0238738.
DOI:10.1371/journal.pone.0238738.
[41] Fukai, Yuh. (2020). Some Fundamental Properties of Hydrogen and Water. 10.1007/978-981-15-7157-2_5.
Autores:
Eduardo Ochoa Hernández
Nicolás Zamudio Hernández
Abraham Zamudio Durán
Lizbeth Guadalupe Villalon Magallan
Mónica Rico Reyes
Pedro Gallegos Facio
Gerardo Sánchez Fernández
Rogelio Ochoa Barragán