Texto de apropiación científica y tecnológica_____________________________
Módulo 3. Patogénesis y Diagnóstico o
3.1 ¿Cómo se propagan los virus en el organismo?
3.2 Puertas de entrada y replicación inicial.
3.3 Vías de propagación de virus en el cuerpo
3.3.1 Infecciones restringidas localmente
3.3.2 Diseminación linfohematogénica
3.3.3 Diseminación Neurogénica
3.4 Manifestación de la infección en órganos específicos
3.4.1 Piel y membranas mucosas
3.4.2 Pulmón
3.4.3 Otros órganos como sitios de manifestación después de la diseminación linfohematógena
3.4.4 El feto como lugar de manifestación
3.5 Métodos de laboratorio para detectar infecciones virales
3.5.1 ¿Cómo se pueden detectar los virus directamente?
3.5.2 Cultivo viral y sistemas de detección derivados
3.6 ¿Cómo se utilizan las reacciones inmunitarias específicas para la detección indirecta de infecciones virales?
3.6.1 Detección de proteínas Western Blot
3.6.2 Antígeno ELISA
3.6.3 Pruebas de inmunofluorescencia directa
3.6.4 Detección de las propiedades del virus
3.6.5 Detección directa de virus en material de pacientes
3.6.6 Reacción en cadena de la polimerasa
3.6.7 Reacciones inmunitarias específicas para la detección indirecta de infecciones virales
______________________________________________________
3.1 ¿Cómo se propagan los virus en el organismo?
La patogénesis describe la propagación de un virus en el organismo y la relación mutua entre el patógeno y su huésped durante la infección. Estos procesos se pueden analizar de varias formas utilizando diferentes métodos histológicos, virológicos e inmunológicos. Las infecciones virales pueden ser con o sin síntomas (también llamados cursos de infección aparente o no aparente). En ambos casos, el organismo huésped responde con respuestas inmunológicas de defensa, que suelen conducir a la superación de los síntomas primarios de la enfermedad ya la eliminación del virus. La respuesta inmunitaria también puede contribuir en el contexto de la inmunopatogénesis a los síntomas de enfermedades específicas y al daño temporal o permanente del huésped. El curso típico de una infección viral aguda normalmente se manifiesta en una etapa de la enfermedad con síntomas específicos similares a los de la gripe; en muchos casos, se puede observar después una cura directa de la enfermedad. Sin embargo, esta fase de la enfermedad suele ir seguida de un intervalo sin síntomas de unos pocos días, al que sigue una segunda fase específica de la enfermedad con síntomas orgánicos típicos (figura 3.1). En ambos casos, el sistema inmunitario puede tener éxito en la eliminación del patógeno. Ocasionalmente, los virus pueden establecer infecciones persistentes y permanecer en el organismo de por vida a pesar de la defensa inmune inducida. Algunos virus producen constantemente descendencia de virus que son excretados por los huéspedes y transmitidos a otros organismos vivos no infectados, por ejemplo, en infecciones crónicas persistentes por el virus de la hepatitis B, el virus de la hepatitis C o el virus de la inmunodeficiencia humana (VIH). En otros casos, aunque se controla la reproducción del patógeno, la información genética permanece latente en las células de determinados tejidos. Los patógenos pueden reactivarse en determinadas circunstancias para producir descendencia.
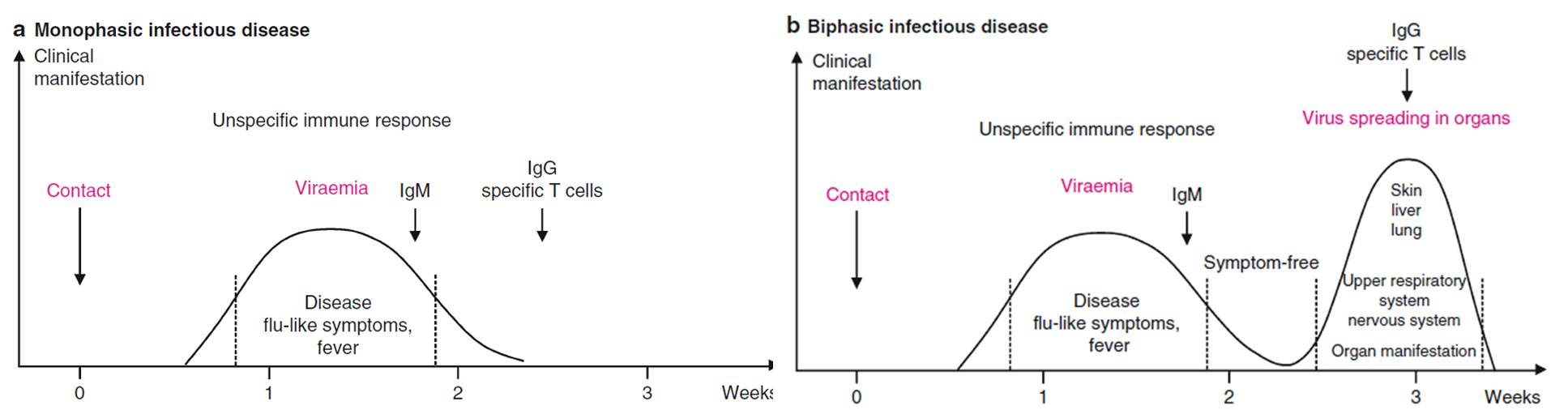
Fig. 3.1 Curso temporal del desarrollo de la enfermedad en infecciones virales agudas. (a) Infección con curso monofásico de la enfermedad con síntomas similares a los de la gripe y durante la fase activa, causando síntomas de enfermedad. Ejemplos bien conocidos son el virus de la varicela-zoster y el virus del herpes simple, que son miembros de la familia de los herpesvirus.
El concepto de patogenicidad de un virus describe su potencial para producir enfermedades en una determinada especie huésped. Se basa en las actividades de los productos génicos virales, que determinan en su totalidad y en su interacción entre sí y con los componentes celulares las propiedades causantes de enfermedades. Con frecuencia, un agente causal es patógeno solo para una única especie huésped. Por ejemplo, el VIH causa el síndrome de inmunodeficiencia adquirida (SIDA) únicamente en humanos, mientras que el virus de la peste porcina clásica infecta solo a los cerdos e induce la peste porcina en ellos.
El término “virulencia” se refiere a la gravedad de la infección viral. Es el potencial patógeno de un virus y los diversos grados de propiedades patógenas dentro de una especie viral. Los rasgos incrustados en los genes de virulencia son responsables de la virulencia; estos pueden ser atenuados o mejorados por mutaciones. Por otro lado, las diferencias genéticas entre las especies hospedadoras también influyen en la expresión de las propiedades patogénicas de un virus, lo que puede conducir a un aumento o atenuación de los síntomas e incluso a la resistencia a ciertas infecciones. Los genes del huésped son responsables de estos efectos, que, por ejemplo, evitan la unión de virus a células específicas o controlan su propagación en el organismo. Si una respuesta inmunitaria específica ya está presente en un organismo debido a una infección previa con el mismo virus o uno relacionado, también puede prevenir la infección o mitigar una enfermedad.
3.2 Puertas de entrada y replicación inicial
Muchos virus llegan a las membranas mucosas de la boca, la nariz y la garganta a través de la infección por gotitas (incluidos coronavirus, paramixovirus, orthomixovirus y adenovirus. En otros casos, la mucosa genital es el sitio de entrada, por ejemplo, de muchos virus del papiloma o virus del herpes simple tipo 2. Muchos picornavirus, como el poliovirus y el virus de la hepatitis A, pero también los norovirus y los rotavirus como miembros de las familias de calicivirus y reovirus, acceden al estómago y al intestino a través de alimentos contaminados y entran en contacto con las células de las regiones de las membranas mucosas. En el caso de los flavivirus y los bunyavirus, los patógenos ingresan al torrente sanguíneo a través de la picadura de artrópodos infectados y pueden infectar las células endoteliales de los vasos sanguíneos o directamente ciertas células sanguíneas. Al igual que las secreciones salivales de mosquitos y garrapatas, los virus también llegan al torrente sanguíneo de un organismo por vía parenteral cuando están presentes como contaminación en transfusiones de sangre y productos sanguíneos o en agujas de jeringas o instrumentos médico quirúrgicos que se utilizan para intervenciones quirúrgicas. Las agujas contaminadas con el VIH, pero también con el virus de la hepatitis B y el virus de la hepatitis C, que son frecuentemente utilizadas conjuntamente por varias personas en el abuso de drogas por vía intravenosa, son una fuente de infección que permite que estos agentes infecciosos penetren directamente en el torrente sanguíneo, donde pueden infectar los monocitos y Células T CD4+, en las que se multiplican. Por otro lado, el virus de la rabia ingresa a la herida a través de la mordedura de vertebrados infectados y se replica inicialmente en las células musculares. Incluso las lesiones cutáneas pequeñas pueden proporcionar sitios de entrada ideales para los virus, incluidos los virus del papiloma y los virus del herpes. Ya en los puntos de entrada, los virus encuentran células en las que pueden multiplicarse localmente. Sin embargo, en el curso de la evolución, los organismos han desarrollado células en todos los tejidos que, como componentes activos del sistema inmunitario innato o adquirido, contrarrestan la invasión de patógenos y su propagación. Estos incluyen neutrófilos y ciertos tejidos, como los tejidos linfáticos que están asociados con las membranas mucosas, que también se denominan tejido linfático asociado al intestino y tejido linfático asociado a los bronquios. Los parches o placas de Peyer de la mucosa intestinal tienen una función similar, y el anillo amigdalino de Waldeyer de la garganta, que incluye las amígdalas como tejido linfoide, también tiene una función análoga. La epidermis de la piel contiene células de Langerhans, es decir, células dendríticas específicas de tejido, que tienen la función de detectar patógenos, ingerirlos y transportarlos a los ganglios linfáticos más cercanos, donde desencadenan otras reacciones de la respuesta inmunitaria. Además de las células dendríticas, los macrófagos también tienen funciones importantes en la defensa contra infecciones en etapas tempranas de infección. Migran al tejido infectado y pueden fagocitar virus o sus proteínas y presentar los péptidos respectivos en antígenos MHC de clase II en su superficie celular. Los macrófagos se activan y secretan, de manera similar a las células epiteliales o endoteliales infectadas por virus, citocinas e interferones, que a su vez estimula otras células inmunológicamente activas. También contribuyen al desarrollo de reacciones inflamatorias locales. Si esto ocurre, por ejemplo, en el área mucosa de la garganta, tal reacción puede inducir los síntomas familiares del resfriado.
3.3 Vías de propagación de los virus en el cuerpo
3.3.1 Infecciones restringidas localmente
En algunos casos, la reproducción viral y los síntomas permanecen restringidos localmente al sitio de entrada. Esto es cierto, por ejemplo, para los virus del papiloma humano, que se transmiten desde el exterior a la superficie de la piel, superan las capas externas de la piel a través de lesiones menores y se replican en el sitio de entrada, lo que induce la proliferación celular y conduce a la formación de verrugas. Los virus no atraviesan la lámina basal de la piel. La diseminación se produce por la liberación de partículas infecciosas del virus del papiloma de la verruga, que luego pueden infectar otras áreas de la piel y formar focos de replicación. Las células T citotóxicas migran a estas áreas de la piel y reconocen las células infectadas por los péptidos antigénicos de las proteínas virales que se presentan en los antígenos MHC de clase I. El foco de infección permanece limitado debido a la lisis de las células productoras de virus. En el caso de la conjuntivitis causada por adenovirus, los patógenos llegan desde el exterior del ojo y la infección se limita a la conjuntiva. Las células inmunológicamente activas migran hacia el ojo y provocan una inflamación. Las infecciones por rinovirus humanos afectan el tracto respiratorio superior y permanecen confinadas a las membranas mucosas de esta región. Los virus que primero infectan la membrana mucosa de la boca y la garganta pueden diseminarse continuamente por toda la mucosa del tracto respiratorio después de los ciclos iniciales de replicación en el sitio de la infección. También pueden diseminarse al oído medio o colonizar áreas inferiores del tracto respiratorio sin diseminación por el torrente sanguíneo. Esto se aplica principalmente a los virus de la parainfluenza y la influenza patógenos humanos. Una propagación continua similar, pero en la mucosa intestinal, se encuentra en muchos enterovirus y en calicivirus y rotavirus.
3.3.2 Diseminación linfohematogénica
Las células presentadoras de antígenos, como las células de Langerhans, las células dendríticas y los macrófagos, pueden identificar e ingerir virus o componentes proteicos virales individuales en el sitio de entrada. Estas células se cargan con las partículas y proteínas del virus y migran a los centros inmunológicamente activos de los ganglios linfáticos más cercanos, encontrando allí otras células inmunitarias como los linfocitos T CD4+ y CD8+, los linfocitos B y los macrófagos, que comienzan a proliferar por contacto con el patógeno, proteínas o con complejos MHC-péptido y por la influencia de citocinas secretadas por células inmunitarias activadas. Esta es la razón de la inflamación de los ganglios linfáticos, que se observa en muchas infecciones virales. En los ganglios linfáticos también hay células que pueden ser infectadas por muchos virus. Los virus de la progenie abandonan los ganglios linfáticos y se liberan en el líquido linfático y el torrente sanguíneo; generan una viremia primaria, difícil de detectar, ya que suele ser transitoria. Las infecciones generalizadas son consecuencia de la diseminación en el organismo. En otros casos, los patógenos no se liberan. Más bien, permanecen en un estado unido a las células y las células infectadas las propagan a través del cuerpo, por ejemplo el VIH por linfocitos T CD4+ y macrófagos, y citomegalovirus por granulocitos y monocitos. Los patógenos ligados a células o libres llegan al sistema reticulohistiocitario, que consiste en diferentes tipos de células que son capaces de fagocitar o almacenar sustancias y partículas, y por lo tanto también virus. En ellos proliferan y dan lugar a una viremia secundaria comúnmente pronunciada, lo que posibilita la eficaz diseminación del virus por todo el organismo. Solo entonces los respectivos virus alcanzan sus sitios de replicación finales y pueden causar síntomas típicos en los órganos afectados.
3.3.3 Diseminación Neurogénica
Algunos virus pueden infectar las células nerviosas durante su diseminación en el organismo. Además del virus de la rabia, varios herpesvirus (como el virus del herpes simple y el virus de la varicela-zóster) han desarrollado esta propiedad, que les permite propagarse a lo largo de las fibras nerviosas. Durante las etapas iniciales de la infección, los virus de la rabia migran desde las células musculares infectadas hacia las terminaciones nerviosas libres en el sitio de la mordedura. En este caso, los virus no se propagan ni por el torrente sanguíneo ni por el líquido linfático del cuerpo. Más bien, migran a lo largo de las fibras nerviosas en el axón del sistema nervioso periférico a través de la médula espinal hacia el cerebro. Solo en la fase tardía de la infección hay una propagación centrífuga desde el cerebro a través de los nervios hacia la periferia. De esta forma, los virus de la rabia llegan a los diversos órganos, incluidas las glándulas salivales, a través de las cuales también son excretados. Por el contrario, el virus del herpes simple, que se transmite preferentemente por contacto directo, infecta principalmente las células epiteliales de la piel. La colonización del sistema nervioso periférico se produce posteriormente, a partir de los primeros sitios de proliferación en la piel. Los virus infectan las terminaciones nerviosas libres y migran de manera retrógrada a través de las vías nerviosas hacia los ganglios, donde persisten durante toda la vida. En caso de reactivación, el virus vuelve a migrar a la piel, donde se produce una nueva recaída. Durante las infecciones por el virus del herpes simple de la conjuntiva y la córnea, los patógenos reactivados migran desde los ganglios de las fibras nerviosas hacia el ojo, donde pueden diseminarse en el epitelio de la córnea y causar inflamaciones.
3.4 Manifestación de la infección en órganos específicos
Los virus alcanzan sus órganos diana por diseminación linfohematogénica. Allí proliferan inicialmente en las respectivas células endoteliales que recubren la superficie interna de todos los vasos sanguíneos y linfáticos como una sola capa celular. Alcanzan el parénquima, es decir, el tejido específico de un órgano, atravesando los espacios intercelulares existentes entre las células endoteliales (libres o unidas a macrófagos, linfocitos T CD4+ o granulocitos). Como resultado de la replicación viral, las proteínas extrañas están presentes en altas concentraciones. Las células inmunológicamente activas son atraídas hacia las regiones de los órganos infectados y reaccionan con la secreción de diversas citocinas y quimiocinas. Esto puede resultar en respuestas inflamatorias masivas que tienen razones inmunopatogenéticas y están determinadas por la naturaleza de cada virus infectante y el sitio de colonización dentro del tejido. Los detalles sobre la patogénesis y la manifestación relacionada de la enfermedad en varios órganos se discutirán en la revisión de los distintos virus en las secciones correspondientes. Aquí sólo se describen algunos mecanismos básicos.
3.4.1 Piel y membranas mucosas
Los virus que causan los resfriados infectan las membranas mucosas de la boca y la garganta. Con frecuencia, estos virus se propagan continuamente desde la mucosa de las vías respiratorias, sin traspasar la sangre y, por lo tanto, sin diseminación hematógena. Esto se aplica, por ejemplo, a los rinovirus, el virus respiratorio sincitial y el virus parainfluenza. En otras infecciones víricas se encuentra una diseminación linfohematogénica concomitante en el organismo, durante la cual la mucosa de las vías respiratorias se vuelve a infectar secundariamente. Esto es válido, por ejemplo, para el virus del sarampión. Sin embargo, las células inmunológicamente activas, como los macrófagos y los granulocitos, que están presentes en las membranas mucosas, se activan por fagocitosis de partículas virales o proteínas. Reaccionan con la liberación de diversas quimiocinas y citocinas, mientras que las células dendríticas activadas (mediante la ingesta de proteínas virales) migran hacia los ganglios linfáticos más cercanos y activan los linfocitos B y T. Las quimiocinas y las citocinas suelen ser proteínas de baja masa molecular, que se difunden a través de la membrana basal hacia los vasos, e inducen en las células endoteliales una mayor síntesis de proteínas de adhesión como la molécula de adhesión intercelular, la molécula de adhesión de células vasculares y la molécula de adhesión de leucocitos endoteliales, a las que circulan se adhieren los linfocitos. De esta forma se induce la migración de otros macrófagos, granulocitos y linfocitos activados, que se desplazan desde los vasos hacia el lugar de la infección. Simultáneamente, la actividad de las citocinas en las células infectadas aumenta la síntesis de antígenos MHC clase I y clase II, que presentan fragmentos peptídicos de proteínas virales e inducen la formación de células T citotóxicas específicas y células T colaboradoras. Dado que estos últimos, a su vez, también secretan citocinas, la inducción de citocinas se refuerza aún más. Todos estos procesos deberían contribuir a inhibir la replicación viral y frenarla localmente. En algunas enfermedades virales, esta barrera inmunoprotectora puede romperse, especialmente en pacientes inmunocomprometidos. Entonces, incluso las infecciones secundarias son posibles después de la diseminación hematógena en la mucosa del tracto digestivo. Es el caso, por ejemplo, del citomegalovirus, que provoca lesiones epiteliales y ulceraciones de la mucosa intestinal de los pacientes inmunodeprimidos. En enfermedades virales asociadas con exantemas como el sarampión y la varicela, los patógenos infectan las células endoteliales de los vasos capilares y, posiblemente, las células de la piel después de la diseminación hematógena en el organismo. La inflamación, que es causada por la replicación viral en las células de la piel y por la subsiguiente inducción de la respuesta inmune, se manifiesta como una erupción. Se pueden distinguir dos formas de exantema: 1. Exantemas en los que los patógenos proliferan activamente en las células de la piel, como el virus del herpes simple y el virus de la varicela-zoster, poxvirus, virus del papiloma. 2. Exantemas en los que los virus no se replican activamente en las células de la piel, sino que se depositan en los capilares como complejos con anticuerpos. Esto desencadena la respuesta inmune y, por lo tanto, las reacciones de inflamación. Dichas variantes de erupción se encuentran en infecciones por el virus de la rubéola y el virus del sarampión, virus del herpes humano 6 y parvovirus B19.
3.4.2 Pulmón
Las infecciones pulmonares se manifiestan preponderantemente como inflamación de los bronquios y bronquiolos, o neumonía; son causados ??con mayor frecuencia por el virus respiratorio sincitial y por los virus de la influenza, los virus parainfluenza y los adenovirus, pero también por el virus del sarampión. Por su continua diseminación, las partículas virales alcanzan la mucosa bronquial, las ramas más finas del árbol bronquial, e infectan las células epiteliales tanto de los bronquios como de los alvéolos. Estas células se hinchan, bloquean los alvéolos y finalmente se desprenden. Las sobreinfecciones bacterianas del epitelio bronquial dañado por virus pueden agravar la enfermedad e inducir bronconeumonía bacteriana secundaria y neumonía intersticial.
3.4.3 Otros órganos como sitios de manifestación después de la diseminación linfohematógena
Las formas de conjuntivitis que se observan en las infecciones por el virus del sarampión probablemente ocurren después de la diseminación hematógena del virus en el organismo, y no por transmisión exógena al ojo, como ocurre con los adenovirus. Durante su diseminación hematógena virémica, los coxsackievirus infectan particularmente el músculo cardíaco y el pericardio, causando inflamaciones en estos órganos. Normalmente, ambas formas de la enfermedad curan, pero la miocarditis puede adoptar formas crónicas.
3.4.4 El feto como lugar de manifestación
El sistema circulatorio del niño en crecimiento está separado del de la madre por la barrera placentaria. Impide que las células maternas lleguen al feto. Sin embargo, las proteínas y las sustancias de bajo peso molecular pueden atravesar esta barrera. En mujeres embarazadas, los virus diseminados por vía hematógena, como el virus de la rubéola, el citomegalovirus y el parvovirus B19, se transportan a través del torrente sanguíneo hacia la placenta e infectan las células endoteliales de este órgano. Como resultado de la infección de la placenta, los patógenos pueden transmitirse verticalmente al feto y establecer una infección infantil. Como resultado, existen embriopatías o fetopatías duraderas, que también pueden conducir a la muerte del feto. Además, existen otros órganos mediante los cuales se manifiestan las enfermedades virales; por ejemplo entre el sistema sanguíneo y el sistema nervioso central, hígado, etc.
3.5 Métodos de laboratorio para detección de infecciones virales
3.5.1 ¿Cómo se pueden detectar los virus directamente?
Los primeros métodos para la detección de infecciones bacterianas estuvieron disponibles alrededor de 1880. Después de la tinción, los patógenos bacterianos se reconocían en el microscopio óptico debido a su tamaño y podían cultivarse en medios de cultivo. Los virus evadieron este enfoque, ya que son significativamente más pequeños y, como parásitos obligados, no pueden multiplicarse en medios de cultivo celular.
Hoy en día, las infecciones virales se pueden detectar directamente mediante la determinación de los agentes, las proteínas virales individuales o su información genética, u otros materiales en la sangre de personas o animales infectados mediante el uso de métodos apropiados. La detección directa de virus es posible, con la excepción de formas de infección latente o persistente, solo durante la fase aguda de la enfermedad. En algunos casos, los patógenos están presentes en el organismo infectado solo antes de la fase sintomática, por lo que la la detección del virus con frecuencia no tiene éxito. Por lo tanto, las infecciones o el contacto con patógenos generalmente se demuestran en el diagnóstico de virus indirectamente mediante la caracterización de la respuesta inmune específica en desarrollo.
3.5.2 Cultivo viral y sistemas de detección derivados
Para el cultivo y la propagación de la mayoría de los virus, hoy en día se dispone de líneas celulares en continuo crecimiento. El material del paciente preferentemente estéril a investigar, como sangre, suero, lavado faríngeo u orina, se limpia toma la muestra de el área afectada y se incuba con las células en un volumen pequeño. Después de la unión de las partículas de virus a las células, se agrega un medio que contiene antibiótico a los cultivos para evitar el crecimiento de bacterias que pueden estar presentes como contaminación en el material de prueba. En los días siguientes se revisan microscópicamente las células en busca de cambios morfológicos, como la aparición de efectos citopáticos, placas en la capa celular por muerte celular, cuerpos de inclusión y células gigantes, que permiten una primera inferencia sobre el virus replicante, y también sirven como evidencia de que los virus infecciosos estaban presentes en el material de partida. La forma clásica de cultivo viral generalmente implica un período de incubación relativamente largo de 1 a 4 semanas. Una versión abreviada es el ensayo de vial de concha. En este método, las células susceptibles se incuban con el material que contiene el virus sospechoso en los pocillos de una microtitulación, una placa de 24 pocillos o sobre portaobjetos de vidrio en tubos de centrífuga y se centrifugan a baja velocidad. Esto probablemente altera la fluidez de la membrana citoplasmática de las células, lo que conduce a una penetración más rápida de los patógenos. Después de la incubación durante 1 o 2 días, las proteínas virales pueden demostrarse en las células mediante inmunofluorescencia o procedimientos similares. Actualmente, las líneas celulares primarias apenas se utilizan para el cultivo de virus patógenos humanos. Solo tienen una capacidad de división limitada; por lo tanto, deben establecerse repetidamente. Una excepción son los fibroblastos del prepucio, que se utilizan ocasionalmente para el cultivo del virus del herpes simple. En particular, el uso rutinario de células madre embrionarias, que poseen una mayor capacidad de división, está muy regulado. Sin embargo, para otras células humanas primarias también debe demostrarse que están libres de virus después del cultivo, en particular, no deben contener virus de hepatitis crónica (B, C, D) o virus de inmunodeficiencia humana (VIH). En medicina veterinaria, las líneas celulares primarias se utilizan comúnmente en casos excepcionales para el cultivo de ciertos virus patógenos en virología avícola.
3.6 ¿Cómo se utilizan las reacciones inmunitarias específicas para la detección indirecta de infecciones virales?
3.6.1 Detección de proteínas Western Blot
Una forma de determinar el tipo de virus es la identificación de antígenos virales específicos en las pruebas de Western blot. Para ello, las proteínas de las células infectadas o de las partículas virales previamente sedimentadas por ultracentrifugación se separan mediante electroforesis en un gel de poliacrilamida con dodecilsulfato sódico. Su patrón y masas moleculares pueden proporcionar evidencia del tipo de virus. Sin embargo, una asignación final solo es posible serológicamente en el Western blot (Fig. 3.2). Para ello, las proteínas separadas se transfieren del gel de poliacrilamida a una membrana de nitrocelulosa o nailon y luego se incuban con antisueros que contienen inmunoglobulinas, que reaccionan específicamente con los antígenos virales de interés (anticuerpo primario). Lo óptimo son las preparaciones de anticuerpos monoclonales de ratón que reconocen epítopos definidos de una proteína viral. También se pueden usar sueros de personas que han resistido una infección con el tipo de virus correspondiente y, por lo tanto, han producido anticuerpos que se unen específicamente. A continuación, las membranas de nitrocelulosa se tratan con otros denominados anticuerpos secundarios, que son específicos de las regiones Fc del anticuerpo primario; por ejemplo, con inmunoglobulinas de cerdo, que fueron inoculadas con regiones Fc de moléculas de anticuerpos murinos, y han desarrollado una respuesta inmune contra anticuerpos murinos. Los anticuerpos humanos generalmente se detectan con inmunoglobulinas de conejo, que se unen a las regiones Fc de la IgG humana. Las diferentes enzimas necesarias para las posteriores reacciones de detección se unen covalentemente al anticuerpo secundario. Estos anticuerpos secundarios interactúan con los complejos antígeno-anticuerpo en las membranas y, en el siguiente paso, se detectan agregando el sustrato adecuado, en este caso diaminobencidina. En el caso positivo, surgen bandas proteicas parduscas (fig. 3.2).
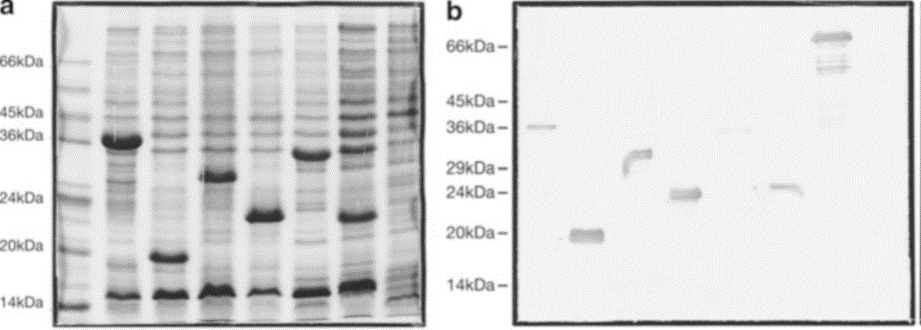
Fig. 3.2 Ejemplo para la detección de proteínas virales. (a) Gel de dodecilsulfato de sodio-poliacrilamida. Los extractos de proteínas de la bacteria Escherichia coli que expresan diferentes regiones de una proteína del parvovirus B19 se separaron electroforéticamente y se tiñeron con azul de Coomassie. Todas las proteínas presentes en la preparación presentan un color azul (aquí en negro). (b) Transferencia de Western. Las bandas de proteína del gel de dodecilsulfato de sodio-poliacrilamida que se muestra en (a) se transfirieron a una membrana de nitrocelulosa (Western blot) y luego se incubaron con anticuerpos policlonales de conejo que reconocen específicamente la proteína del parvovirus. Después de un procedimiento de lavado, la membrana se trató con anticuerpos secundarios que se conjugan con inmunoglobulinas que se dirigen contra la región Fc de los anticuerpos (conejo) y se unen específicamente a los anticuerpos primarios unidos. Posteriormente, la membrana se incubó con soluciones de diaminobencidina. En el área de las bandas de proteínas a las que se han unido los complejos de anticuerpos, se produce un precipitado marrón que indica una respuesta positiva. Alternativamente, el uso de fosfatasa alcalina para marcar (color azul).
3.6.2 Antígeno ELISA
Esta variante de ELISA se emplea para detectar proteínas o partículas virales como alternativa al Western blot analítico. La prueba generalmente se realiza en placas de microtitulación que contienen 96 pocillos y están hechas de poliestireno especialmente tratado. Los anticuerpos monoclonales murinos contra una proteína viral específica se unen a la superficie de los pocillos de plástico. A continuación, se añaden a los pocillos suspensiones que contienen el virus en cuestión o las proteínas virales de interés. Si los antígenos relevantes están presentes, interactuarán con las inmunoglobulinas unidas a poliestireno. Los complejos antígeno-anticuerpo pueden detectarse en el siguiente paso mediante la adición de otro anticuerpo, que se une a un epítopo diferente de la misma proteína viral. Estas inmunoglobulinas se conjugan covalentemente con peroxidasa de rábano picante, por lo que el complejo se puede visualizar mediante la adición de o-fenilendiamina como sustrato soluble. La medición fotométrica de la intensidad de esta reacción cromática hace posible una determinación cuantitativa o semicuantitativa del antígeno viral presente en el material de partida (fig. 3.3a). Ejemplos de aplicaciones de antígeno ELISA en medicina humana son infecciones con adenovirus, virus de influenza, virus de parainfluenza y virus respiratorios sincitiales en secreciones respiratorias y rotavirus, adenovirus y norovirus en heces. En medicina veterinaria, el antígeno ELISA se utiliza para detectar rotavirus, coronavirus y parvovirus en varias especies animales.
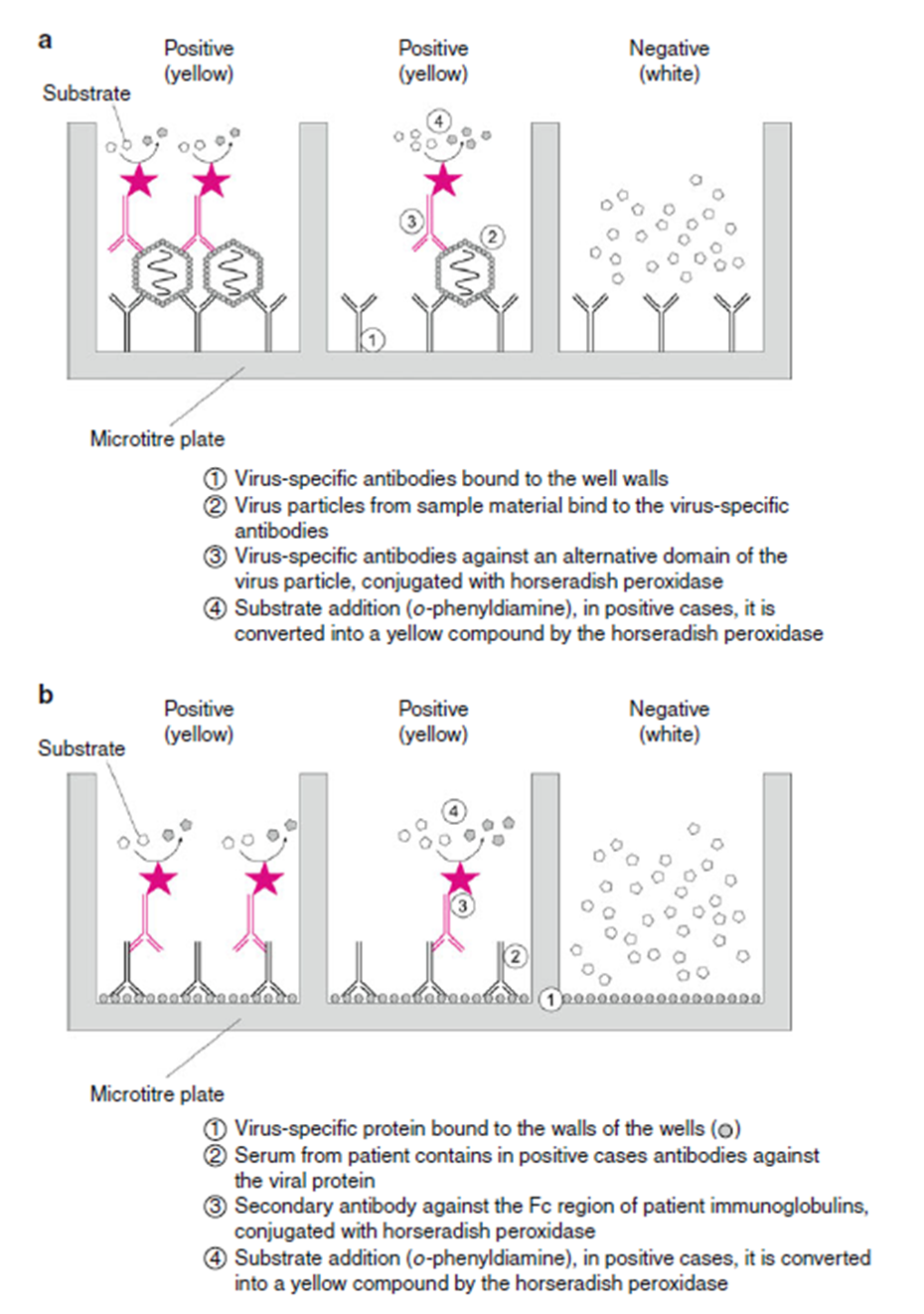
Fig. 3.3 Los pasos de reacción en diferentes tipos de ELISA. (a) ELISA de captura de antígeno para detectar proteínas o partículas virales. (b) ELISA para detectar anticuerpos específicos.
3.6.3 Pruebas de inmunofluorescencia directa
La inmunofluorescencia directa se usa para investigar si las células infectadas producen proteínas virales. Las células se dejan caer sobre portaobjetos, se fijan y se tratan con disolventes alcohólicos para hacer permeables las membranas celulares. Posteriormente, se incuban con inmunoglobulinas dirigidas contra las proteínas virales a detectar. El siguiente tratamiento con anticuerpos secundarios, que se dirigen contra la región Fc de las inmunoglobulinas utilizadas anteriormente y se unen a compuestos fluorescentes (por ejemplo, isotiocianato de fluoresceína), permite visualizar proteínas virales en diferentes compartimentos, como el núcleo, el citoplasma y la célula (fig. 3.4).
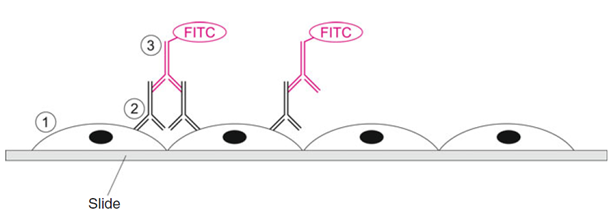
1- Células fijas infectadas
2- Anticuerpos específicos, por ejemplo en sueros de pacientes
3. Anticuerpo secundario contra la región Fc de las inmunoglobulinas humanas; si están unidos, las estructuras celulares que son reconocidas por el complejo se tiñen de verde debido al marcado con isotiocianato de fluoresceína (FITC)
Fig. 3.4. Los pasos de reacción en la prueba de inmunofluorescencia.
3.6.4 Detección de las propiedades del virus
Algunos virus codifican actividades enzimáticas específicas, que pueden detectarse como propiedades características en células infectadas o asociadas con partículas virales en el sobrenadante del cultivo. Estos incluyen, por ejemplo, la determinación de la actividad transcriptasa inversa, que es producida por los virus de la inmunodeficiencia humana y es un componente de las partículas virales resultantes. Sobre la base de la cantidad de esta enzima detectada en el sobrenadante del cultivo, el número de partículas virales producidas puede determinarse cuantitativamente. Otros virus son capaces de aglutinar eritrocitos. Esta capacidad de hemaglutinación se encuentra tanto en virus patógenos humanos como en virus patógenos animales. Se asocia con las proteínas de la envoltura viral y, por lo tanto, con los viriones. Por lo tanto, las pruebas de hemaglutinación se pueden realizar, entre otros, con paramixovirus y ortomixovirus, así como con flavivirus, togavirus, coronavirus y parvovirus. Se usan eritrocitos de especies apropiadas y se mezclan con las suspensiones que contienen virus; si los glóbulos rojos se aglutinan, esto indica la presencia de virus. Si la reacción se puede inhibir agregando anticuerpos específicos del virus, entonces esta llamada prueba de inhibición de la hemaglutinación permite determinar el tipo de virus en el material de partida. Sin embargo, este método se ha vuelto obsoleto en el diagnóstico de rutina. Hoy en día, la prueba de inhibición de la hemaglutinación solo se realiza para detectar anticuerpos específicos contra el virus de la rubéola en el contexto de la atención materna reglamentaria.
3.6.5 Detección directa de virus en material de pacientes
Muchas de las pruebas de diagnóstico utilizadas son tan sensibles que también pueden usarse para la detección de virus en sueros u otros materiales de pacientes sin cultivo in vitro previo y propagación de patógenos. Esto se aplica especialmente a las infecciones en las que se producen y liberan en la sangre grandes cantidades de partículas virales o proteínas específicas. Sin embargo, existen pruebas muy sensibles que permiten la detección viral disponible en cantidades relativamente pequeñas.
3.6.6 Reacción en cadena de la polimerasa
La reacción en cadena de la polimerasa (PCR) permite la amplificación de cantidades muy pequeñas de genomas virales o transcripciones directamente del material del paciente. Teórica y prácticamente, es posible detectar incluso una sola molécula de ácido nucleico en la muestra de prueba. Inicialmente, los virus deben romperse (por ejemplo, utilizando agentes caotrópicos) y las proteínas que están presentes en la muestra deben eliminarse, ya que pueden interferir con las reacciones posteriores. Normalmente se degradan con proteasas o se eliminan mediante extracción con fenol y luego se precipitan y eliminan de las muestras mediante centrifugación. Se deben seleccionar dos oligonucleótidos (cebador) (de 15 a 20 nucleótidos de longitud) que sean complementarios a cada hebra del ADN bicatenario, flanqueando una región de 200 a 400 bases (en PCR en tiempo real también significativamente más corta). El ADN se convierte en cadenas sencillas mediante desnaturalización por calor (normalmente a 94 ºC). Posteriormente, los cebadores se agregan en un alto exceso molar y se hibridan con las cadenas de ADN respectivas durante el recocido y forman regiones cortas de doble cadena (recocido, generalmente a 50–60 ºC). La mezcla de reacción también contiene una forma termoestable de ADN polimerasa (generalmente Taq polimerasa de la bacteria termófila Thermus aquaticus) y los cuatro nucleósidos trifosfatos dATP, dGTP, dCTP y dTTP en concentraciones y sistemas tampón apropiados. Los oligonucleótidos hibridados funcionan como cebadores. Proporcionan los extremos 30-OH libres necesarios, en los que la polimerasa Taq sintetiza la secuencia de ADN complementaria (alargamiento o extensión de la cadena, normalmente a 72 Cº). Este paso completa el primer ciclo. Como resultado, dos moléculas de ADN de doble cadena están presentes en la mezcla de reacción, que se separan nuevamente mediante un breve paso de desnaturalización por calor, que inicia el segundo ciclo. Durante el siguiente ciclo, los oligonucleótidos se hibridan de nuevo con las cadenas simples y sirven como cebador para la síntesis de otras cadenas dobles: así, la molécula de ADN original se ha amplificado en una reacción en cadena a cuatro moléculas de cadena doble. Los ciclos se repiten tantas veces como se desee, logrando una amplificación logarítmica de las moléculas de ácido nucleico (2n, n es el número de ciclos (Fig. 3.5). Después de alrededor de 30 a 40 ciclos, la fase de amplificación logarítmica termina debido al agotamiento de los reactivos y la enzima; los productos de amplificación por PCR pueden separarse mediante electroforesis en gel de agarosa y visualizarse mediante tinción con bromuro de etidio. Para fines analíticos, como la clonación de productos de amplificación, también es posible diseñar los cebadores de tal manera que contengan sitios únicos de escisión de enzimas de restricción. Si se escinde el ADN de doble cadena amplificado, el fragmento resultante puede identificarse según su tamaño después de la separación de la mezcla de reacción mediante electroforesis en gel de agarosa ; o se puede procesar más. Dado que el ADN es muy estable durante largos períodos de tiempo, sus secuencias pueden detectarse en muestras de tejido más antiguas e incluso fijadas. Por lo tanto, los virus pueden detectarse en muestras muy antiguas conservadas en formaldehído e incluso en momias embalsamadas. El uso de la técnica PCR también permite investigar cómo ciertos tipos de virus, por ejemplo, virus de la gripe, han cambiado y desarrollado en los últimos siglos. Esto puede proporcionar información más precisa sobre la evolución viral. Si el ácido nucleico original es ARN, se convierte principalmente en ADN monocatenario utilizando una transcriptasa inversa y un cebador adecuado. Esto es seguido por las reacciones de amplificación descritas anteriormente. Ambas reacciones se pueden realizar en el mismo tubo de reacción y utilizando condiciones tampón idénticas. La polimerasa Taq también se puede modificar para que pueda catalizar ambas reacciones. Con el uso de estándares de control apropiados, también es posible determinar la cantidad de ácido nucleico en el material de partida, como en sueros. A menudo, una desventaja es la alta sensibilidad del método de PCR, (dado que es posible amplificar incluso una sola molécula de ADN), una contaminación mínima en la mezcla de reacción es suficiente para generar resultados falsos positivos. Este riesgo es especialmente elevado en los laboratorios de diagnóstico, donde los materiales pertinentes se manipulan de forma rutinaria. Por lo tanto, según la aplicación de la PCR, todas las soluciones, tampones y mezclas de reacción que se utilicen para la PCR deben prepararse y pipetearen salas separadas (compartimentación espacial); además, se deben realizar controles negativos en todas las pruebas para indicar una posible contaminación. Hoy en día, existen sistemas de prueba automatizados que permiten la determinación cuantitativa de ácidos nucleicos virales en el material de partida (PCR en tiempo real). Para ello, las moléculas de ADN o ARN se amplifican como se ha descrito anteriormente. Se añade a la mezcla de reacción un conjunto definido de sondas monocatenarias que tienen una longitud de 25 a 40 nucleótidos y son complementarias a las secuencias de las regiones amplificadas. Estas sondas específicas de secuencia están marcadas con un grupo fluorescente en el extremo 50 (p. Ejemplo, 6-carboxifluoresceína). Por el contrario, llevan una sustancia química diferente grupo en el extremo 30 (por ejemplo, 6-carboxitetrametilrodamina) que suprime la fluorescencia de la 6-carboxifluoresceína. El requisito previo para este efecto de extinción es que los dos grupos estén ubicados cerca uno del otro, por ejemplo, en los dos extremos de cada sonda (tecnología de transferencia de resonancia de energía fluorescente). Si los genomas virales están presentes en la muestra, los nucleótidos de la sonda se degradan por la actividad exonucleasa de la polimerasa Taq durante el proceso de polimerización. Este paso conduce a la separación de los dos grupos fluorescentes. El efecto de extinción se suprime con este paso y la fluorescencia de la 6-carboxifluoresceína se puede medir en tiempo real. Cuanto más ácido nucleico viral había en el material de partida, mayor era la intensidad de fluorescencia. Los procedimientos comunes tienen una eficiencia de amplificación logarítmica de seis a ocho magnitudes logarítmicas. Con el uso de varios pares de cebadores y sondas marcadas diferencialmente, también se pueden detectar varios productos de amplificación de manera específica y cuantitativa en un solo ensayo (PCR múltiplex). Por lo tanto, los controles internos son posibles para verificar tanto la eficiencia de extracción de ADN como las posibles inhibiciones internas. Otra ventaja de la PCR en tiempo real es la reducción significativa del riesgo de contaminación del producto final. Alternativamente, las secuencias de ADN amplificadas pueden detectarse cuantitativamente en un ensayo de captura de híbridos similar a ELISA. Los productos de amplificación se extraen de la solución mediante una sonda específica que se une a las placas de microtitulación de poliestireno. Si se agregan cebadores biotinilados o derivados de nucleótidos al paso de amplificación, entonces pueden detectarse mediante anticuerpos conjugados con peroxidasa.
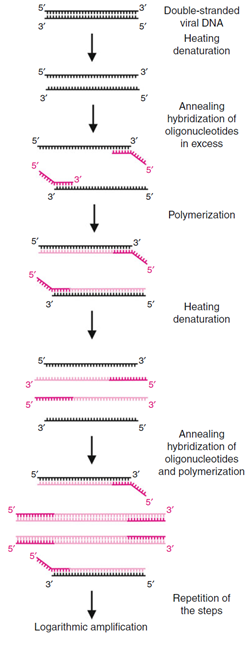
Fig. 3.5 Principio de la reacción en cadena de la polimerasa
3.6.7 Reacciones inmunitarias específicas para la detección indirecta de infecciones virales
Como ya se mencionó, los virus están presentes y pueden detectarse a menudo solo por un corto tiempo en los pacientes. Por lo tanto, con frecuencia se debe hacer un diagnóstico de manera indirecta, es decir, determinando la respuesta inmunitaria que se provoca contra un patógeno dado durante la infección. Por lo general, se detectan anticuerpos del paciente que se unen específicamente a proteínas virales específicas en el suero y, a veces, en el líquido cefalorraquídeo. Los anticuerpos IgM generalmente indican una infección aguda o reciente. Por el contrario, si se detectan anticuerpos IgG contra un virus específico, se puede inferir una infección pasada o anterior. También son indicativos de un estado inmunitario que protege a la persona de una nueva infección por el mismo patógeno. Especialmente para el diagnóstico de infecciones agudas, es importante determinar la concentración de anticuerpos IgM e IgG durante la infección. A veces, también se utiliza la prueba de inhibición de la hemaglutinación. Si se van a asociar funciones específicas con las inmunoglobulinas, tales como su capacidad para neutralizar el virus correspondiente, entonces se examina si las inmunoglobulinas pueden inhibir la infección in vitro. Para este propósito, se incuban cantidades específicas de partículas de virus infecciosos con anticuerpos antes de agregar la mezcla a las células de un cultivo de tejidos.